Διατροφή πριν από την προπόνηση αντοχής-Όλα όσα πρέπει να γνωρίζετε μέσα από 165 έρευνες (Μέρος Α’)
Runbeat Team 14:42 18-01-2023

Από τους Ολυμπιονίκες έως τους χομπίστες δρομείς αναψυχής, δηλαδή οι αθλητές όλων των επιπέδων αντιμετωπίζουν το ίδιο ερώτημα: Tι πρέπει να τρώω πριν την άσκηση και πώς επηρεάζει την προπόνησή μου;
Παρά το γεγονός ότι το ερώτημα σχετίζεται με οποιονδήποτε κάνει άσκηση εντούτοις πολλά ερωτήματα σχετικά με τις επιπτώσεις της διατροφικής πρόσληψης στις απαντήσεις και τις προσαρμογές της προπόνησης αντοχής παραμένουν αναπάντητα.
Η διάρκεια και η ένταση της άσκησης είναι οι πιο σημαντικοί παράγοντες που επηρεάζουν την προσαρμοστική απόκριση στην προπόνηση αντοχής. Ωστόσο, οι στρατηγικές που αλλάζουν τη διαθεσιμότητα θρεπτικών ουσιών πριν και κατά τη διάρκεια της άσκησης μπορούν επίσης να επηρεάσουν τις προσαρμογές της προπόνησης διαμορφώνοντας το ερέθισμα της άσκησης ή και τις κυτταρικές αποκρίσεις στις διαταραχές που προκαλούνται από την άσκηση.
Συγκεκριμένες στρατηγικές για την αλλαγή της διαθεσιμότητας θρεπτικών συστατικών μπορεί να περιλαμβάνουν την άσκηση σε κατάσταση ολονύκτιας νηστείας, τον περιορισμό της πρόσληψης υδατανθράκων (CHO) μεταξύ των προπονήσεων και την αύξηση της πρόσληψης CHO πριν ή κατά τη διάρκεια της άσκησης. Αν και η απόδοση μπορεί να βελτιωθεί μετά την κατανάλωση CHO πριν από την άσκηση, η άσκηση που πραγματοποιείται με μειωμένη διαθεσιμότητα CHO μπορεί να αυξήσει την ενεργοποίηση των βασικών πρωτεϊνών σηματοδότησης σε σύγκριση με την άσκηση που εκτελείται με υψηλή διαθεσιμότητα CHO, επηρεάζοντας δυνητικά μακροχρόνια τις προπονητικές προσαρμογές.
Ερευνητές από το Πανεπιστήμιο του Ώκλαντ στη Νέα Ζηλανδία προχώρησαν σε ανασκόπηση όλων των μέχρι σήμερα δεδομένων για την επίδραση της πρόσληψης διατροφής πριν από την άσκηση .
Είναι γνωστό ότι η κατανάλωση υδατανθράκων πριν την άσκηση μειώνει την οξείδωση του λίπους αλλά υπάρχουν λίγα στοιχεία που δείχνουν ενισχυμένη ικανότητα καύσης λίπους μετά από μακροχρόνια προπόνηση σε κατάσταση νηστείας. Ωστόσο είναι αδιαμφισβήτητο γεγονός ότι η απόδοση βελτιώνεται μετά από κατανάλωση υδατανθράκων και πριν από την άσκηση μεγάλης διάρκειας, όχι όμως και για μικρής διάρκειας. Ενώ οι βελτιώσεις απόδοσης που προκαλούνται από την προπόνηση μετά από διατροφικές στρατηγικές που ρυθμίζουν τη διαθεσιμότητα υδατανθράκων ποικίλλουν ανάλογα με τον τύπο του διατροφικού πρωτοκόλλου που χρησιμοποιείται.
Τα ευρήματα που σχετίζονται με την επίδραση της οξείας πρόσληψης υδατανθράκων στη μιτοχονδριακή σηματοδότηση μπορεί να σχετίζονται με την ποσότητα υδατανθράκων που καταναλώνεται και την ένταση της άσκησης.
Έτσι αυτή η ερευνητική ανασκόπηση μπορεί να βοηθήσει στην καθοδήγηση των αθλητών, των προπονητών και των διατροφολόγων στην εξατομίκευση των διατροφικών στρατηγικών πριν από την άσκηση και στο σχεδιασμό ερευνητικών μελετών για να διευκρινιστεί περαιτέρω ο ρόλος της διατροφής στις προσαρμογές της προπόνησης αντοχής.
Αυτά τα σήματα επηρεάζονται τόσο από τη διάρκεια και την ένταση μιας συνεδρίας άσκησης, όσο και από τις διατροφικές επιλογές ενός αθλητή πριν από την άσκηση (δηλαδή, το μέγεθος, το είδος και το χρονοδιάγραμμα των γευμάτων πριν από την άσκηση).
Οι αντιφάσεις θολώνουν το «άριστο» πρωτόκολλο διατροφής
Αν και ορισμένες σειρές στοιχείων υποδηλώνουν ότι η κατανάλωση CHO πριν από την άσκηση μπορεί να επηρεάσει αρνητικά τις προσαρμογές της προπόνησης αντοχής, έχουν αναφερθεί αντίθετα ευρήματα. Για παράδειγμα, η κατανάλωση CHO μειώθηκε , αυξήθηκε ή δεν είχε καμία επίδραση στη δραστηριότητα της πρωτεϊνικής κινάσης (AMPK) μετά από άσκηση. Ομοίως, οι βελτιώσεις που προκαλούνται από την προπόνηση στη μέγιστη κατανάλωση οξυγόνου (VO2max) έχουν αναφερθεί ότι αυξάνονται , μειώνονται ή παραμένουν αμετάβλητες μετά από 4-6 εβδομάδες κατανάλωσης CHO σε σύγκριση με την προπόνηση σε κατάσταση νηστείας.
Αυτά τα αντιφατικά ευρήματα μπορεί να αποτελέσουν πηγή σύγχυσης και μπορεί να εξηγήσουν γιατί οι πεποιθήσεις και οι πρακτικές που σχετίζονται με τον ρόλο και την επιρροή της διατροφής πριν από την άσκηση ποικίλλουν τόσο πολύ μεταξύ των προπονητών και των αθλητών . Συνεπώς, ο σκοπός αυτής της ανασκόπησης ήταν να τονίσει την τρέχουσα γνώση για την επίδραση της πρόσληψης διατροφής πριν από την άσκηση στις μεταβολικές, φυσιολογικές και επιδόσεις αποκρίσεις στην προπόνηση αντοχής.
Oι άμεσες αντιδράσεις στην πρόσληψη διατροφής πριν από την άσκηση
Η συντριπτική πλειοψηφία των διατροφικών παρεμβάσεων πριν από την άσκηση έχουν διεξαχθεί σε οξύ πλαίσιο. Αν και οι οξείες αποκρίσεις στην προπόνηση δεν αντιστοιχούν πάντα με μακροπρόθεσμες προσαρμογές , η συσσώρευση με την πάροδο του χρόνου παροδικών αλλαγών που προκαλούνται από την άσκηση στη γονιδιακή έκφραση θεωρείται ότι είναι ο κινητήριος παράγοντας πίσω από πολλές προσαρμογές στην προπόνηση . Ως εκ τούτου, είναι σημαντικό να ληφθούν υπόψη οι οξείες επιπτώσεις της διατροφής πριν από την άσκηση εκτός από τις πιο μακροπρόθεσμες προσαρμογές.
Το ήπαρ παίζει βασικό ρόλο στη μεταβολική ρύθμιση κατά τη διάρκεια της εκτεταμένης άσκησης. Παρά τη μείωση περίπου κατά ~ 40% του ηπατικού γλυκογόνου μετά από ολονύκτια νηστεία , η συγκέντρωση της γλυκόζης στο αίμα μπορεί να διατηρηθεί σε φυσιολογικά επίπεδα κατά τη διάρκεια της άσκησης λόγω αυξημένης γλυκονεογένεσης ή και μειωμένης χρήσης της γλυκόζης στους σκελετικούς μύες . Ωστόσο η κόπωση κατά την εκτεταμένη άσκηση συχνά σχετίζεται με μειωμένες συγκεντρώσεις γλυκόζης στο αίμα , υποστηρίζοντας έναν κρίσιμο ρόλο για το γλυκογόνο του ήπατος στην επίτευξη βέλτιστης απόδοσης κατά την παρατεταμένη άσκηση.
Τουλάχιστον 6 ώρες μετά το τελευταίο γεύμα για να τεθούμε σε κατάσταση νηστείας
Η άσκηση σε κατάσταση νηστείας επιτρέπει γενικά υψηλότερα επίπεδα οξείδωσης λίπους από την άσκηση που εκτελείται σε κατάσταση τροφοδοσίας CHO κατά τη διάρκεια άσκησης χαμηλής έως μέτριας έντασης και μπορεί να αυξήσει τη σχετική ένταση όπου εμφανίζεται η μέγιστη οξείδωση λίπους . Η κατάποση CHO πριν από την άσκηση αυξάνει τα επίπεδα γλυκόζης και ινσουλίνης στο πλάσμα, οδηγώντας σε μείωση της ηπατικής παροχής γλυκόζης και αύξηση της πρόσληψης γλυκόζης από τους σκελετικούς μυς κατά τη διάρκεια της άσκησης . Αυτό μπορεί να μειώσει την οξείδωση του λίπους μειώνοντας τη διαθεσιμότητα των FFA (λιπαρών οξέων) στο πλάσμα μέσω αναστολής της λιπόλυσης που προκαλείται από την ινσουλίνη και επίσης αναστέλλοντας την οξείδωση του λίπους μέσα στον μυ λόγω αυξημένης γλυκολυτικής ροής.
Τα ενδομυϊκά τριγλυκερίδια (IMTG) παρέχουν ένα βασικό υπόστρωμα για την οξείδωση του λίπους, κυρίως κατά τη διάρκεια της άσκησης σε κατάσταση νηστείας , αν και η χρήση τους μειώνεται όσο παρατείνεται η διάρκεια της άσκησης, ενώ αυξάνεται η οξείδωση των FFA του πλάσματος . Μπορεί να χρειαστούν έως και 6 ώρες μετά από ένα γεύμα πλούσιο σε CHO για την οξείδωση του υποστρώματος και την ομοιόσταση της γλυκόζης για να επανέλθουν στα επίπεδα που παρατηρήθηκαν κατά την άσκηση σε κατάσταση νηστείας.
Σε αντίθεση με την άσκηση που εκτελείται σε κατάσταση ολονύκτιας νηστείας, η οποία μειώνει το ηπατικό αλλά όχι το μυϊκό γλυκογόνο, ο περιορισμός της CHO μεταξύ των προπονήσεων επιτρέπει την άσκηση με μειωμένες συγκεντρώσεις γλυκογόνου στους μυς . Κατά τη διάρκεια της άσκησης με χαμηλό μυϊκό γλυκογόνο υπάρχει αύξηση στην οξείδωση του λίπους και των αμινοξέων και μείωση της διάσπασης του μυϊκού γλυκογόνου . Κατά τη διάρκεια της άσκησης που πραγματοποιείται με φυσιολογικά επίπεδα μυϊκού γλυκογόνου, η διάσπαση του μυϊκού γλυκογόνου είναι παρόμοια μεταξύ της άσκησης με σίτιση και της άσκησης σε κατάσταση νηστείας και μπορεί να μειωθεί κατά την κατάποση CHO (υδατανθράκων) κατά τη διάρκεια της άσκησης.
Ο ρόλος της πρωτεΐνης
Οι περισσότερες-μέχρι σήμερα- μελέτες που εξετάζουν την οξείδωση του λίπους έχουν συγκρίνει το CHO με ένα εικονικό φάρμακο, αλλά η χρήση της κατάποσης πρωτεΐνης πριν από την άσκηση αντιπροσωπεύει ένα ενδιαφέρον αλλά λιγότερο ερευνημένο πεδίο. Η κατανάλωση πρωτεΐνης πριν και κατά τη διάρκεια της άσκησης σε σταθερή κατάσταση δεν επηρέασε τη διαθεσιμότητα FFA ή την οξείδωση του λίπους ολόκληρου του σώματος σε σύγκριση με την άσκηση σε κατάσταση νηστείας που ξεκίνησε με φυσιολογική ή μειωμένη συγκέντρωση μυϊκού γλυκογόνου, παρά τα αυξημένα επίπεδα ινσουλίνης. Αυτό μπορεί να σχετίζεται με τις αυξήσεις των επιπέδων των κατεχολαμινών κατά τη διάρκεια της άσκησης, οι οποίες είναι ένας σημαντικός καθοριστικός παράγοντας του λιπολυτικού ρυθμού του λιπώδους ιστού και μπορούν να παρακάμψουν την αναστολή από την ινσουλίνη. Αν και η κατάποση πρωτεΐνης πριν από την άσκηση σε κατάσταση χαμηλού γλυκογόνου δεν έχει καμία επίδραση στους ρυθμούς σύνθεσης πρωτεϊνών των μυών, είναι εύλογο ότι θα μπορούσε να μειώσει τη διάσπαση της μυϊκής πρωτεΐνης κατά τη διάρκεια της άσκησης. Φαίνεται επίσης πιθανό ότι η κατάποση πρωτεΐνης πριν από την άσκηση αυξάνει την οξείδωση των αμινοξέων κατά τη διάρκεια της άσκησης αλλά θα απαιτηθεί στο μέλλον περαιτέρω ποσοτικοποίηση της επιρροής της μέσα από νεότερες και πιο στοχευμένες έρευνες.
Ερευνητικά δεδομένα από 165 μελέτες
Η ομάδα του πανεπιστημίου του Ώκλαντ για να συγκρίνει την επίδραση της κατανάλωσης CHO πριν από την άσκηση, των επιπέδων μυϊκού γλυκογόνου και του γλυκαιμικού δείκτη στην οξείδωση του υποστρώματος και τη δραστηριότητα AMPK, συγκεντρώσε τα αποτελέσματα 165 μελετών (διαθέσιμων ως συμπληρωματικών διαδικτυακών αρχείων) που περιλάμβαναν τις σχετικές ομάδες παρέμβασης .Συνολικά οι μελέτες περιελάμβαναν 1245 άτομα (12,8% γυναίκες), με μέση ηλικία, ΔΜΣ και VO2max 25,4 ± 3,1 έτη, 23,2 ± 1,4 kg m2 και 56,7 ± 8,2 mL kg−1 min−1.
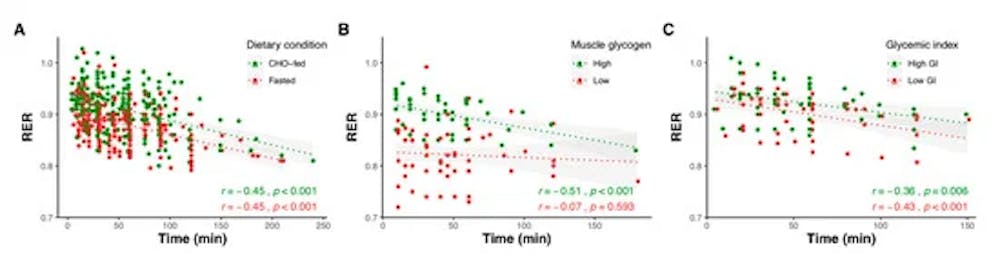
Οξείδωση υποστρώματος σε σχέση με τη διάρκεια της άσκησης για μελέτες που αναφέρουν αναλογία αναπνευστικής ανταλλαγής (RER) σε πολλαπλά χρονικά σημεία που συγκρίνουν άσκηση ολονύκτιας νηστείας ή και τροφοδοσίας CHO με φυσιολογικά επίπεδα μυϊκού γλυκογόνου (Α), άσκηση που πραγματοποιείται με υψηλά (471 ± 208 mmol kg−1 ξηρή μάζα) και χαμηλά (232 ± 112 mmol kg−1 ξηρή μάζα) επίπεδα μυϊκού γλυκογόνου (B) και μετά από υψηλά (82 ± 10) και χαμηλά (36 ± 9) γεύματα γλυκαιμικού δείκτη (C). Οι σκιασμένες περιοχές αντιπροσωπεύουν 95% διαστήματα εμπιστοσύνης. Τα δεδομένα ελήφθησαν με τη συγκέντρωση αποτελεσμάτων από 60 μελέτες.
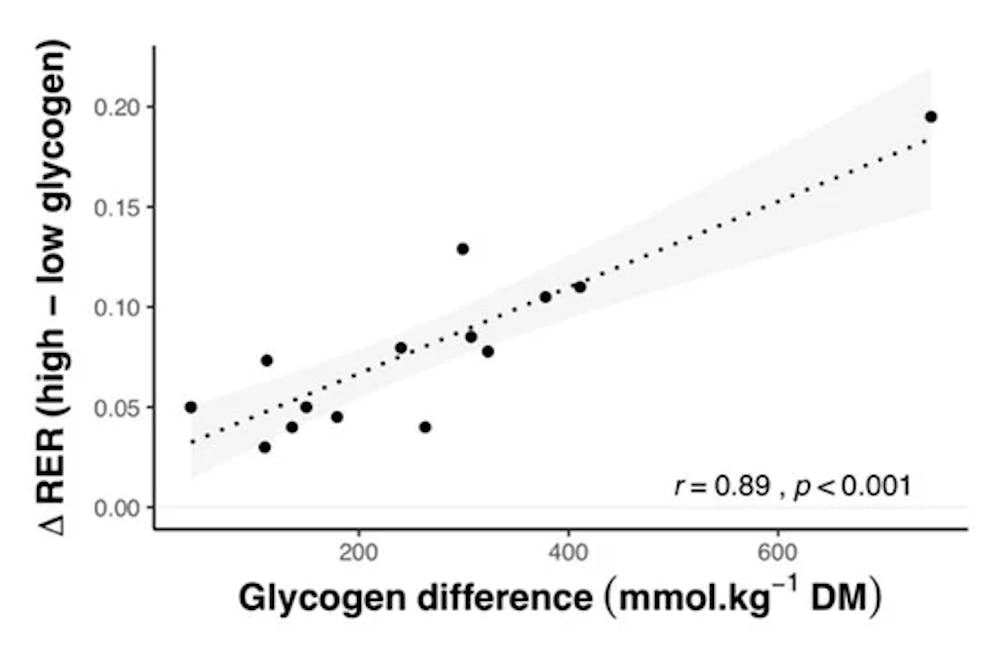
Συσχέτιση μεταξύ των διαφορών στην αναλογία αναπνευστικής ανταλλαγής (RER) κατά τη διάρκεια της άσκησης και των διαφορών στα επίπεδα γλυκογόνου πριν από την άσκηση. Η σκιασμένη περιοχή αντιπροσωπεύει το 95%. Τα δεδομένα ελήφθησαν από τη συγκέντρωση αποτελεσμάτων από 13 μελέτες που χειρίστηκαν τα επίπεδα γλυκογόνου και ανέφεραν RER για δοκιμές υψηλής και χαμηλής περιεκτικότητας σε γλυκογόνο.
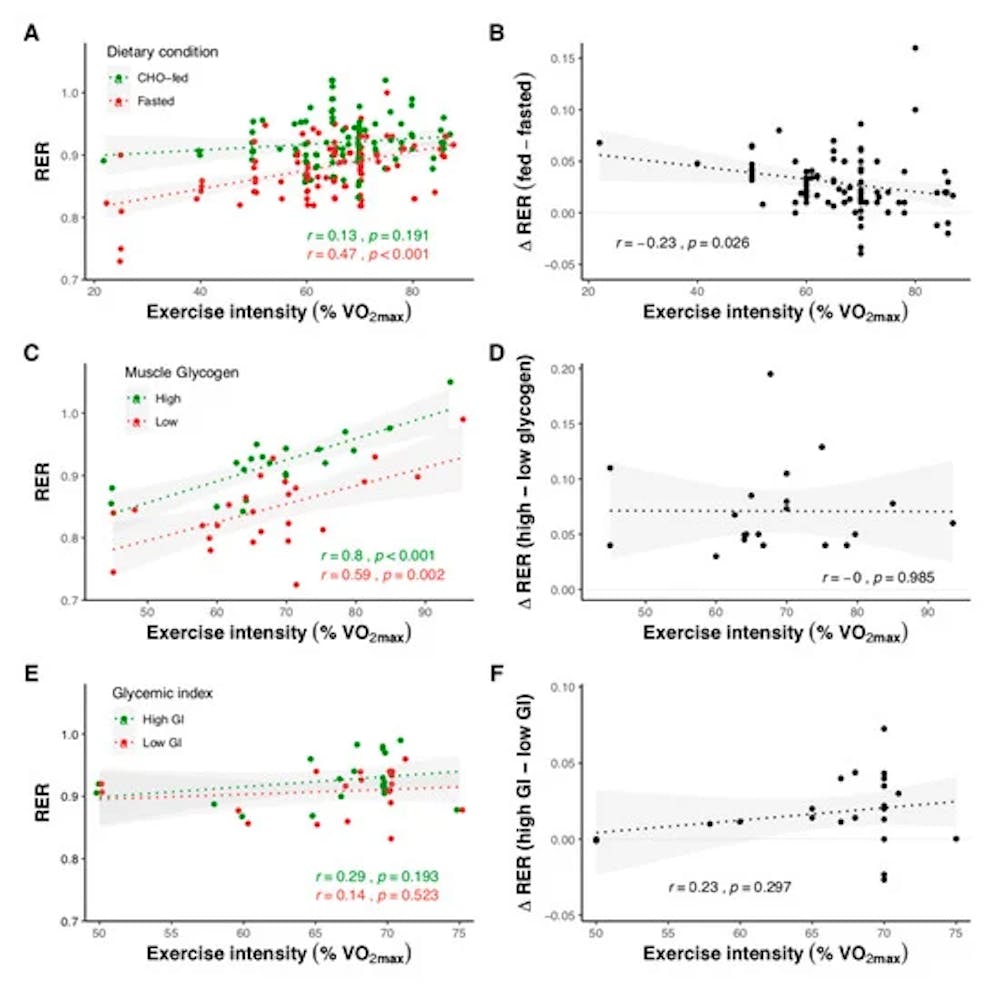
Οξείδωση υποστρώματος σε σχέση με την ένταση άσκησης για μελέτες που συγκρίνουν την ολονύκτια νηστεία και την άσκηση με τροφή CHO με φυσιολογικά επίπεδα μυϊκού γλυκογόνου (A,B), την άσκηση με υψηλή (471 ± 208 mmol kg-1 ξηρή μάζα) και χαμηλή ( 232 ± 112 mmol kg−1 ξηρής μάζας) επίπεδα μυϊκού γλυκογόνου (C,D) και μετά από υψηλά (82 ± 10) και χαμηλά (36 ± 9) γεύματα γλυκαιμικού δείκτη (E,F). Οι σκιασμένες περιοχές αντιπροσωπεύουν το 95%. Τα δεδομένα ελήφθησαν με τη συγκέντρωση αποτελεσμάτων από 103 μελέτες.
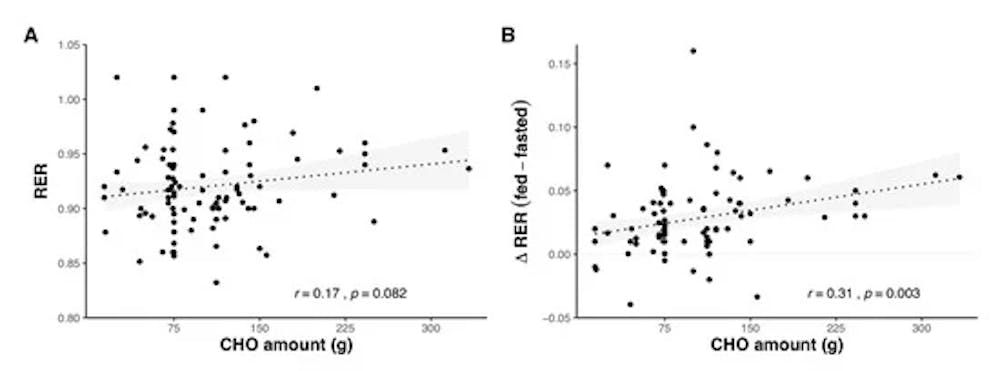
Οξείδωση υποστρώματος σε σχέση με την ποσότητα υδατανθράκων (CHO) που καταναλώθηκε πριν από την άσκηση, ως απόλυτη τιμή RER κατά τη διάρκεια της άσκησης (Α) και διαφορά στο RER μεταξύ της άσκησης σε τροφή και σε κατάσταση νηστείας (Β). Οι σκιασμένες περιοχές αντιπροσωπεύουν το 95% .Τα δεδομένα ελήφθησαν με τη συγκέντρωση αποτελεσμάτων από 76 μελέτες.
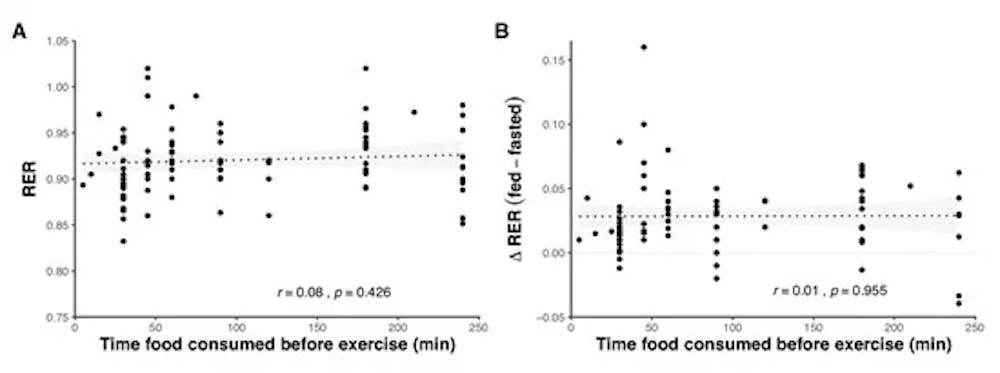
Οξείδωση υποστρώματος σε σχέση με το χρόνο που καταναλώθηκε η τροφή πριν από την άσκηση, ως απόλυτη τιμή RER κατά τη διάρκεια της άσκησης (Α) και διαφορά στο RER μεταξύ της άσκησης που τρέφεται με CHO και της άσκησης σε κατάσταση νηστείας (Β). Οι σκιασμένες περιοχές αντιπροσωπεύουν το 95%. Τα δεδομένα ελήφθησαν με τη συγκέντρωση αποτελεσμάτων από 76 μελέτες.
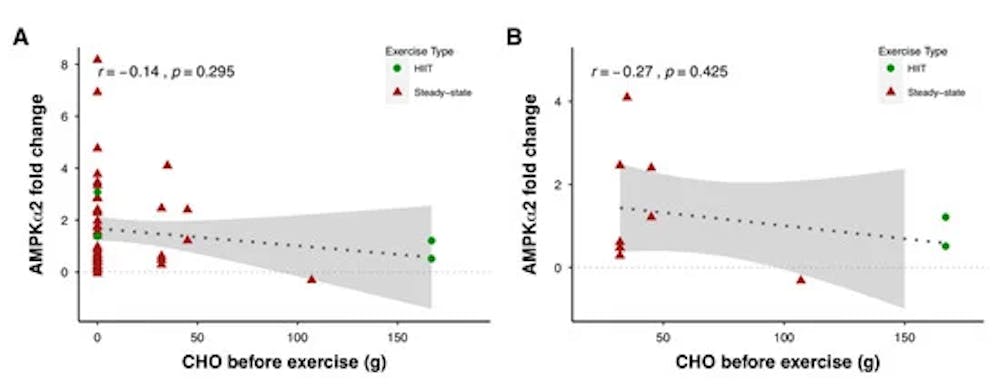
Σχέση μεταξύ της δραστηριότητας AMPKα2 κατά τη διάρκεια της άσκησης (μετρούμενη ως πολλαπλή αλλαγή από τα επίπεδα ανάπαυσης πριν από την άσκηση σε αμέσως μετά την άσκηση) και της πρόσληψης υδατανθράκων (CHO) πριν από την άσκηση, συμπεριλαμβανομένης της (Α) και εξαίρεσης (Β) μελετών που δοκιμάστηκαν κατά τη διάρκεια της νύχτας - κατάσταση νηστείας. HIIT: διαλειμματική προπόνηση υψηλής έντασης. Οι σκιασμένες περιοχές αντιπροσωπεύουν το 95%. Τα δεδομένα ελήφθησαν από τη συγκέντρωση αποτελεσμάτων από 22 μελέτες.
Η επίδραση της διάρκειας της άσκησης
Η αναλογία αναπνευστικής ανταλλαγής (RER - ένα μέτρο της οξείδωσης του υποστρώματος) μειώνεται με τη διάρκεια της άσκησης, υποδεικνύοντας μια αυξανόμενη εξάρτηση από την οξείδωση του λίπους καθώς η διάρκεια της άσκησης παρατείνεται. Οι διαφορές στο RER μεταξύ της άσκησης σε κατάσταση σίτισης έναντι νηστείας και μετά από χαμηλό έναντι υψηλού γλυκαιμικού δείκτη CHO παραμένουν σε μεγάλο βαθμό παρόμοιες καθ' όλη τη διάρκεια της άσκησης, ενώ οι διαφορές στο RER μεταξύ υψηλού και χαμηλού γλυκογόνου στους μυς ως εκκίνηση μειώνονται όσο παρατείνεται η διάρκεια της άσκησης.
Το τελευταίο θα μπορούσε πιθανόν να σχετίζεται με τη μεγαλύτερη χρήση του μυϊκού γλυκογόνου κατά τη διάρκεια της άσκησης που πραγματοποιείται με υψηλότερα επίπεδα γλυκογόνου, οδηγώντας σε περισσότερα παρόμοια επίπεδα κατά τα τελευταία στάδια της άσκησης. Αυτή η ιδέα υποστηρίζεται από τα συγκεντρωτικά δεδομένα, τα οποία δείχνουν μια ισχυρή συσχέτιση μεταξύ των διαφορών στα επίπεδα γλυκογόνου πριν από την άσκηση και των διαφορών στο RER κατά τη διάρκεια της άσκησης
Η ένταση της άσκησης είναι καλά εδραιωμένη για να επηρεάζει την οξείδωση του υποστρώματος κατά τη διάρκεια της άσκησης, με το RER να αυξάνεται με την ένταση. Οι διαφορές στο RER μεταξύ της άσκησης με σίτιση και σε κατάσταση νηστείας είναι μεγαλύτερες σε χαμηλότερες εντάσεις και μειώνονται όσο αυξάνεται η ένταση. Αντίθετα, η άσκηση που γίνεται με χαμηλό μυϊκό γλυκογόνο διατηρεί χαμηλότερες τιμές RER σε σύγκριση με το φυσιολογικό γλυκογόνο, παρά την αυξανόμενη ένταση της άσκησης. Ο γλυκαιμικός δείκτης του γεύματος πριν από την άσκηση φαίνεται να έχει ελάχιστες επιπτώσεις στη σχέση μεταξύ της έντασης και της οξείδωσης του υποστρώματος
Η επίδραση της ποσότητας υδατανθράκων
Αρκετές μελέτες έχουν συγκρίνει άμεσα διαφορετικές ποσότητες CHO (υδατάνθρακες) που λαμβάνονται πριν από την άσκηση. Είτε δεν δείχνουν διαφορές στην οξείδωση του υποστρώματος με ποικίλες ποσότητες CHO πριν από την άσκηση, είτε διαφορές σε όλες τις [ ή τις μερίδες του αγώνα άσκησης. Στο σύνολο των 125 μελετών που συνοψίστηκαν, υπάρχει μια ασθενής θετική σχέση μεταξύ της ποσότητας του CHO που προσλαμβάνεται και του RER κατά τη διάρκεια της επόμενης άσκησης, ενώ οι διαφορές στο RER μεταξύ της άσκησης που τρέφεται με CHO και της άσκησης σε κατάσταση νηστείας αυξάνονται καθώς αυξάνεται η ποσότητα του CHO που προσλαμβάνεται .
Η επίδραση του χρόνου του γεύματος πριν από την άσκηση
Ο χρόνος πριν από την κατανάλωση τροφής για άσκηση είναι ένας άλλος παράγοντας που μπορεί να επηρεάσει το μεταβολισμό και την οξείδωση του υποστρώματος, και οι μελέτες έχουν εξετάσει σε κατάσταση σίτισης ενός χρονικό φάσματος μεταξύ 5 και 240 λεπτών μετά το φαγητό. Αν και οι άμεσες συγκρίσεις της επιρροής του χρόνου γευμάτων είναι περιορισμένες, δεν βρέθηκαν διαφορές στην οξείδωση του υποστρώματος όταν τα ίδια γεύματα καταναλώνονταν 15, 45 ή 75 λεπτά και 30, 60 ή 90 λεπτά [ πριν από την άσκηση. Όταν καταναλώνεται εντός 4 ωρών από την άσκηση, ο χρόνος πριν από την άσκηση δεν βρέθηκε ότι έχει σημαντική επίδραση στην οξείδωση του υποστρώματος
Τα βασικότερα συμπεράσματα
-Κατά τη διάρκεια της υπομέγιστης άσκησης σε σταθερή κατάσταση, η οξείδωση του λίπους είναι γενικά υψηλότερη στην ολονύκτια νηστεία σε σύγκριση με την κατάσταση σίτισης με CHO.
-Αν και η οξείδωση του λίπους αυξάνεται με τη διάρκεια της άσκησης, η άσκηση σε κατάσταση νηστείας αυξάνει την καύση λίπους καθ' όλη τη διάρκεια της άσκησης σε σύγκριση με την κατανάλωση CHO πριν από την άσκηση. Ωστόσο, καθώς η ένταση της άσκησης αυξάνεται, η διαφορά στην οξείδωση του λίπους μεταξύ της άσκησης που τρέφεται με CHO και της άσκησης σε κατάσταση νηστείας μειώνεται.
- Η οξείδωση του λίπους είναι επίσης υψηλότερη όταν κάνετε άσκηση με χαμηλά, σε σύγκριση με τα φυσιολογικά επίπεδα μυϊκού γλυκογόνου, με τις διαφορές να διατηρούνται σε διάφορες εντάσεις άσκησης αλλά να μειώνονται όσο παρατείνεται η διάρκεια της άσκησης.
- Ενώ ο χρόνος πριν από την κατανάλωση της τροφής για άσκηση δεν επηρεάζει σημαντικά την οξείδωση του υποστρώματος, μεγαλύτερες ποσότητες CHO στο γεύμα πριν από την άσκηση οδηγούν σε μεγαλύτερες διαφορές στην οξείδωση του υποστρώματος μεταξύ της άσκησης με σίτιση και σε κατάσταση νηστείας.
Σημειώσεις:
Α) Αυτά τα ευρήματα ισχύουν περισσότερο για μέτρια προπονημένους άνδρες, οι οποίοι αποτελούσαν το ~87% των συμμετεχόντων στη μελέτη ανασκόπησης. Ο μεταβολισμός του υποστρώματος μπορεί να διαφέρει μεταξύ ανδρών και γυναικών, με τις διαφορές να επηρεάζονται περαιτέρω από τον γυναικείο έμμηνο κύκλο και τη χρήση από του στόματος αντισυλληπτικών.
Β) Επιπλέον, οι λιγότερο δραστήριοι έως απροπόνητοι άνθρωποι δεν παρουσιάζουν διαφορές στη γλυκόζη, την ινσουλίνη ή τα FFA μετά την άσκηση μεταξύ των συνθηκών νηστείας και σίτισης ,κάτι που έρχεται σε αντίθεση με τους αθλητές που δείχνουν επίσης μεγαλύτερη ικανότητα για οξείδωση λίπους σε σύγκριση με μη προπονημένους ή αθλούμενου αναψυχής.
Στο Β’ μέρος θα δούμε μεταξύ άλλων ποια είναι η «παγίδα» του να τρέχουμε άδειοι ενεργειακά, πως η ποσότητα και ο τύπος των υδατανθράκων επηρεάζουν τη προπόνηση, ποιες οι προσαρμογές στη μέγιστη αερόβια ικανότητα και εν τέλει αν αξίζει κανείς να προπονείται σε καθεστώς νηστείας.
Η λίστα των 165 μελετών
Seiler, S. What is best practice for training intensity and duration distribution in endurance athletes? Int. J. Sports Physiol. Perform. 2010, 5, 276–291. [Google Scholar] [CrossRef] [PubMed]
Earnest, C.P.; Rothschild, J.; Harnish, C.R.; Naderi, A. Metabolic adaptations to endurance training and nutrition strategies influencing performance. Res. Sports Med. 2019, 27, 134–146. [Google Scholar] [CrossRef] [PubMed]
Stellingwerff, T.; Morton, J.P.; Burke, L.M. A Framework for Periodized Nutrition for Athletics. Int. J. Sport Nutr. Exerc. Metab. 2019, 29, 141–151. [Google Scholar] [CrossRef] [PubMed][Green Version]
Tokmakidis, S.P.; Karamanolis, I.A. Effects of carbohydrate ingestion 15 min before exercise on endurance running capacity. Appl. Physiol. Nutr. Metab. 2008, 33, 441–449. [Google Scholar] [CrossRef]
Sherman, W.M.; Peden, M.C.; Wright, D.A. Carbohydrate feedings 1 h before exercise improves cycling performance. Am. J. Clin. Nutr. 1991, 54, 866–870. [Google Scholar] [CrossRef][Green Version]
Hawley, J.A.; Morton, J.P. Ramping up the signal: Promoting endurance training adaptation in skeletal muscle by nutritional manipulation. Clin. Exp. Pharmacol. Physiol. 2014, 41, 608–613. [Google Scholar] [CrossRef]
Philp, A.; Burke, L.M.; Baar, K. Altering endogenous carbohydrate availability to support training adaptations. Nestle Nutr. Inst. Workshop Ser. 2011, 69, 19–31. [Google Scholar] [CrossRef][Green Version]
Coffey, V.G.; Hawley, J.A. The molecular bases of training adaptation. Sports Med. 2007, 37, 737–763. [Google Scholar] [CrossRef]
Civitarese, A.E.; Hesselink, M.K.; Russell, A.P.; Ravussin, E.; Schrauwen, P. Glucose ingestion during exercise blunts exercise-induced gene expression of skeletal muscle fat oxidative genes. Am. J. Physiol. Endocrinol. Metab. 2005, 289, E1023–E1029. [Google Scholar] [CrossRef][Green Version]
Edinburgh, R.M.; Hengist, A.; Smith, H.A.; Travers, R.L.; Koumanov, F.; Betts, J.A.; Thompson, D.; Walhin, J.P.; Wallis, G.A.; Hamilton, D.L.; et al. Preexercise breakfast ingestion versus extended overnight fasting increases postprandial glucose flux after exercise in healthy men. Am. J. Physiol. Endocrinol. Metab. 2018, 315, E1062–E1074. [Google Scholar] [CrossRef][Green Version]
Lee-Young, R.S.; Palmer, M.J.; Linden, K.C.; LePlastrier, K.; Canny, B.J.; Hargreaves, M.; Wadley, G.D.; Kemp, B.E.; McConell, G.K. Carbohydrate ingestion does not alter skeletal muscle AMPK signaling during exercise in humans. Am. J. Physiol. Endocrinol. Metab. 2006, 291, E566–E573. [Google Scholar] [CrossRef] [PubMed][Green Version]
Van Proeyen, K.; Szlufcik, K.; Nielens, H.; Pelgrim, K.; Deldicque, L.; Hesselink, M.; Van Veldhoven, P.; Hespel, P. Training in the fasted state improves glucose tolerance during fat-rich diet. J. Physiol. 2010, 588, 4289–4302. [Google Scholar] [CrossRef] [PubMed]
Stannard, S.R.; Buckley, A.J.; Edge, J.A.; Thompson, M.W. Adaptations to skeletal muscle with endurance exercise training in the acutely fed versus overnight-fasted state. J. Sci. Med. Sport 2010, 13, 465–469. [Google Scholar] [CrossRef] [PubMed]
De Bock, K.; Derave, W.; Eijnde, B.O.; Hesselink, M.K.; Koninckx, E.; Rose, A.J.; Schrauwen, P.; Bonen, A.; Richter, E.A.; Hespel, P. Effect of training in the fasted state on metabolic responses during exercise with carbohydrate intake. J. Appl. Physiol. (1985) 2008, 104, 1045–1055. [Google Scholar] [CrossRef][Green Version]
Rothschild, J.A.; Kilding, A.E.; Plews, D.J. Prevalence and determinants of fasted training in endurance athletes: A survey analysis. Int. J. Sport Nutr. Exerc. Metab. 2020, 30, 345–356. [Google Scholar] [CrossRef]
Rothschild, J.; Kilding, A.E.; Plews, D.J. Pre-exercise nutrition habits and beliefs of endurance athletes vary by sex, competitive level and diet. J. Am. Coll. Nutr. 2020, in press. [Google Scholar] [CrossRef]
Wadley, G.D.; Nicolas, M.A.; Hiam, D.; McConell, G.K. Xanthine oxidase inhibition attenuates skeletal muscle signaling following acute exercise but does not impair mitochondrial adaptations to endurance training. Am. J. Physiol.-Endocrinol. Metab. 2013, 304, E853–E862. [Google Scholar] [CrossRef][Green Version]
Cochran, A.J.; Percival, M.E.; Tricarico, S.; Little, J.P.; Cermak, N.; Gillen, J.B.; Tarnopolsky, M.A.; Gibala, M.J. Intermittent and continuous high-intensity exercise training induce similar acute but different chronic muscle adaptations. Exp. Physiol. 2014, 99, 782–791. [Google Scholar] [CrossRef][Green Version]
Perry, C.G.; Lally, J.; Holloway, G.P.; Heigenhauser, G.J.; Bonen, A.; Spriet, L.L. Repeated transient mRNA bursts precede increases in transcriptional and mitochondrial proteins during training in human skeletal muscle. J. Physiol. 2010, 588, 4795–4810. [Google Scholar] [CrossRef]
Trefts, E.; Williams, A.S.; Wasserman, D.H. Exercise and the Regulation of Hepatic Metabolism. Prog. Mol. Biol. Transl. Sci. 2015, 135, 203–225. [Google Scholar] [CrossRef][Green Version]
Nilsson, L.H.; Hultman, E. Liver glycogen in man–-the effect of total starvation or a carbohydrate-poor diet followed by carbohydrate refeeding. Scand. J. Clin. Lab. Investig. 1973, 32, 325–330. [Google Scholar] [CrossRef] [PubMed]
Dohm, G.L.; Beeker, R.T.; Israel, R.G.; Tapscott, E.B. Metabolic responses to exercise after fasting. J. Appl. Physiol. 1986, 61, 1363–1368. [Google Scholar] [CrossRef] [PubMed]
Margolis, L.M.; Wilson, M.A.; Whitney, C.C.; Carrigan, C.T.; Murphy, N.E.; Hatch, A.M.; Montain, S.J.; Pasiakos, S.M. Exercising with low muscle glycogen content increases fat oxidation and decreases endogenous, but not exogenous carbohydrate oxidation. Metabolism 2019, 97, 1–8. [Google Scholar] [CrossRef] [PubMed]
Coggan, A.R.; Coyle, E.F. Carbohydrate ingestion during prolonged exercise: Effects on metabolism and performance. Exerc. Sport Sci. Rev. 1991, 19, 1–40. [Google Scholar] [CrossRef]
Vieira, A.F.; Costa, R.R.; Macedo, R.C.O.; Coconcelli, L.; Kruel, L.F.M. Effects of aerobic exercise performed in fasted v. fed state on fat and carbohydrate metabolism in adults: A systematic review and meta-analysis. Br. J. Nutr. 2016, 116, 1153–1164. [Google Scholar] [CrossRef][Green Version]
Andersson Hall, U.; Edin, F.; Pedersen, A.; Madsen, K. Whole-body fat oxidation increases more by prior exercise than overnight fasting in elite endurance athletes. Appl. Physiol. Nutr. Metab. 2015, 41, 430–437. [Google Scholar] [CrossRef] [PubMed][Green Version]
Marmy-Conus, N.; Fabris, S.; Proietto, J.; Hargreaves, M. Preexercise glucose ingestion and glucose kinetics during exercise. J. Appl. Physiol. 1996, 81, 853–857. [Google Scholar] [CrossRef]
Horowitz, J.F.; Mora-Rodriguez, R.; Byerley, L.O.; Coyle, E.F. Lipolytic suppression following carbohydrate ingestion limits fat oxidation during exercise. Am. J. Physiol. 1997, 273, E768–E775. [Google Scholar] [CrossRef] [PubMed]
Coyle, E.F.; Jeukendrup, A.E.; Wagenmakers, A.; Saris, W. Fatty acid oxidation is directly regulated by carbohydrate metabolism during exercise. Am. J. Physiol.-Endocrinol. Metab. 1997, 273, E268–E275. [Google Scholar] [CrossRef]
De Bock, K.; Richter, E.A.; Russell, A.; Eijnde, B.O.; Derave, W.; Ramaekers, M.; Koninckx, E.; Leger, B.; Verhaeghe, J.; Hespel, P. Exercise in the fasted state facilitates fibre type-specific intramyocellular lipid breakdown and stimulates glycogen resynthesis in humans. J. Physiol. 2005, 564, 649–660. [Google Scholar] [CrossRef]
Edinburgh, R.M.; Bradley, H.E.; Abdullah, N.-F.; Robinson, S.L.; Chrzanowski-Smith, O.J.; Walhin, J.-P.; Joanisse, S.; Manolopoulos, K.N.; Philp, A.; Hengist, A.; et al. Lipid metabolism links nutrient-exercise timing to insulin sensitivity in men classified as overweight or obese. J. Clin. Endocrinol. Metab. 2020, 105, 660–676. [Google Scholar] [CrossRef][Green Version]
Van Loon, L.J.; Koopman, R.; Stegen, J.H.; Wagenmakers, A.J.; Keizer, H.A.; Saris, W.H. Intramyocellular lipids form an important substrate source during moderate intensity exercise in endurance-trained males in a fasted state. J. Physiol. 2003, 553, 611–625. [Google Scholar] [CrossRef][Green Version]
Montain, S.J.; Hopper, M.; Coggan, A.R.; Coyle, E.F. Exercise metabolism at different time intervals after a meal. J. Appl. Physiol. 1991, 70, 882–888. [Google Scholar] [CrossRef] [PubMed]
Knapik, J.J.; Meredith, C.N.; Jones, B.H.; Suek, L.; Young, V.R.; Evans, W.J. Influence of fasting on carbohydrate and fat metabolism during rest and exercise in men. J. Appl. Physiol. (1985) 1988, 64, 1923–1929. [Google Scholar] [CrossRef] [PubMed]
Hansen, A.K.; Fischer, C.P.; Plomgaard, P.; Andersen, J.L.; Saltin, B.; Pedersen, B.K. Skeletal muscle adaptation: Training twice every second day vs. training once daily. J. Appl. Physiol. 2005, 98, 93–99. [Google Scholar] [CrossRef] [PubMed][Green Version]
Bartlett, J.D.; Louhelainen, J.; Iqbal, Z.; Cochran, A.J.; Gibala, M.J.; Gregson, W.; Close, G.L.; Drust, B.; Morton, J.P. Reduced carbohydrate availability enhances exercise-induced p53 signaling in human skeletal muscle: Implications for mitochondrial biogenesis. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2013, 304, R450–R458. [Google Scholar] [CrossRef] [PubMed][Green Version]
Gillen, J.B.; West, D.W.D.; Williamson, E.P.; Fung, H.J.W.; Moore, D.R. Low-Carbohydrate Training Increases Protein Requirements of Endurance Athletes. Med. Sci. Sports Exerc. 2019, 51, 2294–2301. [Google Scholar] [CrossRef]
Howarth, K.R.; Phillips, S.M.; MacDonald, M.J.; Richards, D.; Moreau, N.A.; Gibala, M.J. Effect of glycogen availability on human skeletal muscle protein turnover during exercise and recovery. J. Appl. Physiol. (1985) 2010, 109, 431–438. [Google Scholar] [CrossRef][Green Version]
Lemon, P.W.; Mullin, J.P. Effect of initial muscle glycogen levels on protein catabolism during exercise. J. Appl. Physiol. Respir. Environ. Exerc. Physiol. 1980, 48, 624–629. [Google Scholar] [CrossRef]
Weltan, S.M.; Bosch, A.N.; Dennis, S.C.; Noakes, T.D. Preexercise muscle glycogen content affects metabolism during exercise despite maintenance of hyperglycemia. Am. J. Physiol. 1998, 274, E83–E88. [Google Scholar] [CrossRef]
Hargreaves, M.; McConell, G.; Proietto, J. Influence of muscle glycogen on glycogenolysis and glucose uptake during exercise in humans. J. Appl. Physiol. 1995, 78, 288–292. [Google Scholar] [CrossRef] [PubMed]
Devlin, J.T.; Calles-Escandon, J.; Horton, E.S. Effects of preexercise snack feeding on endurance cycle exercise. J. Appl. Physiol. 1986, 60, 980–985. [Google Scholar] [CrossRef] [PubMed]
Neufer, P.D.; Costill, D.L.; Flynn, M.G.; Kirwan, J.P.; Mitchell, J.B.; Houmard, J. Improvements in exercise performance: Effects of carbohydrate feedings and diet. J. Appl. Physiol. 1987, 62, 983–988. [Google Scholar] [CrossRef] [PubMed]
Febbraio, M.A.; Stewart, K.L. CHO feeding before prolonged exercise: Effect of glycemic index on muscle glycogenolysis and exercise performance. J. Appl. Physiol. 1996, 81, 1115–1120. [Google Scholar] [CrossRef] [PubMed]
Tsintzas, K.; Williams, C. Human muscle glycogen metabolism during exercise. Effect of carbohydrate supplementation. Sports Med. 1998, 25, 7–23. [Google Scholar] [CrossRef] [PubMed]
Impey, S.G.; Smith, D.; Robinson, A.L.; Owens, D.J.; Bartlett, J.D.; Smith, K.; Limb, M.; Tang, J.; Fraser, W.D.; Close, G.L. Leucine-enriched protein feeding does not impair exercise-induced free fatty acid availability and lipid oxidation: Beneficial implications for training in carbohydrate-restricted states. Amino Acids 2015, 47, 407–416. [Google Scholar] [CrossRef]
Taylor, C.; Bartlett, J.D.; van de Graaf, C.S.; Louhelainen, J.; Coyne, V.; Iqbal, Z.; MacLaren, D.P.; Gregson, W.; Close, G.L.; Morton, J.P. Protein ingestion does not impair exercise-induced AMPK signalling when in a glycogen-depleted state: Implications for train-low compete-high. Eur. J. Appl. Physiol. 2013, 113, 1457–1468. [Google Scholar] [CrossRef]
Enevoldsen, L.; Simonsen, L.; Macdonald, I.; Bülow, J. The combined effects of exercise and food intake on adipose tissue and splanchnic metabolism. J. Physiol. 2004, 561, 871–882. [Google Scholar] [CrossRef]
Larsen, M.S.; Holm, L.; Svart, M.V.; Hjelholt, A.J.; Bengtsen, M.B.; Dollerup, O.L.; Dalgaard, L.B.; Vendelbo, M.H.; van Hall, G.; Moller, N.; et al. Effects of protein intake prior to carbohydrate-restricted endurance exercise: A randomized crossover trial. J. Int. Soc. Sports Nutr. 2020, 17, 7. [Google Scholar] [CrossRef][Green Version]
Wright, D.; Sherman, W.; Dernbach, A. Carbohydrate feedings before, during, or in combination improve cycling endurance performance. J. Appl. Physiol. 1991, 71, 1082–1088. [Google Scholar] [CrossRef]
Romijn, J.A.; Coyle, E.F.; Sidossis, L.S.; Gastaldelli, A.; Horowitz, J.F.; Endert, E.; Wolfe, R.R. Regulation of endogenous fat and carbohydrate metabolism in relation to exercise intensity and duration. Am. J. Physiol. 1993, 265, E380–E391. [Google Scholar] [CrossRef][Green Version]
Sherman, W.M.; Brodowicz, G.; Wright, D.A.; Allen, W.K.; Simonsen, J.; Dernbach, A. Effects of 4 h preexercise carbohydrate feedings on cycling performance. Med. Sci. Sports Exerc. 1989, 21, 598–604. [Google Scholar] [CrossRef] [PubMed]
Jentjens, R.L.; Cale, C.; Gutch, C.; Jeukendrup, A.E. Effects of pre-exercise ingestion of differing amounts of carbohydrate on subsequent metabolism and cycling performance. Eur. J. Appl. Physiol. 2003, 88, 444–452. [Google Scholar] [CrossRef] [PubMed]
Calles-Escandón, J.; Devlin, J.T.; Whitcomb, W.; Horton, E.S. Pre-exercise feeding does not affect endurance cycle exercise but attenuates post-exercise starvation-like response. Med. Sci. Sports Exerc. 1991, 23, 818–824. [Google Scholar] [PubMed]
Cramp, T.; Broad, E.; Martin, D.; Meyer, B.J. Effects of preexercise carbohydrate ingestion on mountain bike performance. Med. Sci. Sports Exerc. 2004, 36, 1602–1609. [Google Scholar] [CrossRef] [PubMed]
Khong, T.K.; Selvanayagam, V.S.; Hamzah, S.H.; Yusof, A. Effect of quantity and quality of pre-exercise carbohydrate meals on central fatigue. J. Appl. Physiol. 2018, 125, 1021–1029. [Google Scholar] [CrossRef]
Okano, G.; Sato, Y.; Takumi, Y.; Sugawara, M. Effect of 4h preexercise high carbohydrate and high fat meal ingestion on endurance performance and metabolism. Int. J. Sports Med. 1996, 17, 530–534. [Google Scholar] [CrossRef]
Smith, G.J.; Rhodes, E.C.; Langill, R.H. The effect of pre-exercise glucose ingestion on performance during prolonged swimming. Int. J. Sport Nutr. Exerc. Metab. 2002, 12, 136–144. [Google Scholar] [CrossRef]
Coyle, E.F.; Coggan, A.R.; Hemmert, M.K.; Lowe, R.C.; Walters, T.J. Substrate usage during prolonged exercise following a preexercise meal. J. Appl. Physiol. 1985, 59, 429–433. [Google Scholar] [CrossRef]
Whitley, H.A.; Humphreys, S.M.; Campbell, I.T.; Keegan, M.A.; Jayanetti, T.D.; Sperry, D.A.; MacLaren, D.P.; Reilly, T.; Frayn, K.N. Metabolic and performance responses during endurance exercise after high-fat and high-carbohydrate meals. J. Appl. Physiol. 1998, 85, 418–424. [Google Scholar] [CrossRef][Green Version]
Moseley, L.; Lancaster, G.I.; Jeukendrup, A.E. Effects of timing of pre-exercise ingestion of carbohydrate on subsequent metabolism and cycling performance. Eur. J. Appl. Physiol. 2003, 88, 453–458. [Google Scholar] [CrossRef] [PubMed]
Willcutts, K.F.; Wilcox, A.; Grunewald, K. Energy metabolism during exercise at different time intervals following a meal. Int. J. Sports Med. 1988, 9, 240–243. [Google Scholar] [CrossRef] [PubMed][Green Version]
Wismann, J.; Willoughby, D. Gender differences in carbohydrate metabolism and carbohydrate loading. J. Int. Soc. Sports Nutr. 2006, 3, 28–34. [Google Scholar] [CrossRef] [PubMed][Green Version]
Ashley, C.D.; Kramer, M.L.; Bishop, P. Estrogen and substrate metabolism: A review of contradictory research. Sports Med. 2000, 29, 221–227. [Google Scholar] [CrossRef]
Sims, S.T.; Heather, A.K. Myths and Methodologies: Reducing scientific design ambiguity in studies comparing sexes and/or menstrual cycle phases. Exp. Physiol. 2018, 103, 1309–1317. [Google Scholar] [CrossRef][Green Version]
Aird, T.P.; Davies, R.W.; Carson, B.P. Effects of fasted vs. fed state exercise on performance and post-exercise metabolism: A systematic review & meta-analysis. Scand. J. Med. Sci. Sports 2018, 28, 1476–1493. [Google Scholar]
Galloway, S.D.; Lott, M.J.; Toulouse, L.C. Preexercise carbohydrate feeding and high-intensity exercise capacity: Effects of timing of intake and carbohydrate concentration. Int. J. Sport Nutr. Exerc. Metab. 2014, 24, 258–266. [Google Scholar] [CrossRef][Green Version]
Little, J.P.; Chilibeck, P.D.; Ciona, D.; Forbes, S.; Rees, H.; Vandenberg, A.; Zello, G.A. Effect of low- and high-glycemic-index meals on metabolism and performance during high-intensity, intermittent exercise. Int. J. Sport Nutr. Exerc. Metab. 2010, 20, 447–456. [Google Scholar] [CrossRef][Green Version]
Scott, J.P.; Sale, C.; Greeves, J.P.; Casey, A.; Dutton, J.; Fraser, W.D. Effect of fasting versus feeding on the bone metabolic response to running. Bone 2012, 51, 990–999. [Google Scholar] [CrossRef]
Hetlelid, K.J.; Plews, D.J.; Herold, E.; Laursen, P.B.; Seiler, S. Rethinking the role of fat oxidation: Substrate utilisation during high-intensity interval training in well-trained and recreationally trained runners. BMJ Open Sport Exerc. Med. 2015, 1, e000047. [Google Scholar] [CrossRef][Green Version]
Tenforde, A.S.; Barrack, M.T.; Nattiv, A.; Fredericson, M. Parallels with the Female Athlete Triad in Male Athletes. Sports Med. 2016, 46, 171–182. [Google Scholar] [CrossRef] [PubMed]
Wilson, P.B. ‘I think I’m gonna hurl’: A Narrative Review of the Causes of Nausea and Vomiting in Sport. Sports 2019, 7, 162. [Google Scholar] [CrossRef] [PubMed][Green Version]
De Oliveira, E.P.; Burini, R.C.; Jeukendrup, A. Gastrointestinal complaints during exercise: Prevalence, etiology, and nutritional recommendations. Sports Med. 2014, 44 (Suppl. 1), S79–S85. [Google Scholar] [CrossRef] [PubMed][Green Version]
Egan, B.; Zierath, J.R. Exercise metabolism and the molecular regulation of skeletal muscle adaptation. Cell Metab. 2013, 17, 162–184. [Google Scholar] [CrossRef] [PubMed][Green Version]
Hardie, D.G.; Ross, F.A.; Hawley, S.A. AMPK: A nutrient and energy sensor that maintains energy homeostasis. Nat. Rev. Mol. Cell Biol. 2012, 13, 251–262. [Google Scholar] [CrossRef] [PubMed][Green Version]
Steinberg, G.R.; Kemp, B.E. AMPK in Health and Disease. Physiol. Rev. 2009, 89, 1025–1078. [Google Scholar] [CrossRef]
Wojtaszewski, J.F.; Nielsen, P.; Hansen, B.F.; Richter, E.A.; Kiens, B. Isoform-specific and exercise intensity-dependent activation of 5′-AMP-activated protein kinase in human skeletal muscle. J. Physiol. 2000, 528, 221–226. [Google Scholar] [CrossRef]
McConell, G.K.; Wadley, G.D.; Le Plastrier, K.; Linden, K.C. Skeletal muscle AMPK is not activated during 2 h of moderate intensity exercise at∼ 65% VO2 peak in endurance trained men. J. Physiol. 2020, 598, 3859–3870. [Google Scholar] [CrossRef]
Janzen, N.R.; Whitfield, J.; Hoffman, N.J. Interactive Roles for AMPK and Glycogen from Cellular Energy Sensing to Exercise Metabolism. Int. J. Mol. Sci. 2018, 19, 3344. [Google Scholar] [CrossRef][Green Version]
Bartlett, J.D.; Hawley, J.A.; Morton, J.P. Carbohydrate availability and exercise training adaptation: Too much of a good thing? Eur. J. Sport Sci. 2015, 15, 3–12. [Google Scholar] [CrossRef]
Akerstrom, T.C.; Birk, J.B.; Klein, D.K.; Erikstrup, C.; Plomgaard, P.; Pedersen, B.K.; Wojtaszewski, J. Oral glucose ingestion attenuates exercise-induced activation of 5′-AMP-activated protein kinase in human skeletal muscle. Biochem. Biophys. Res. Commun. 2006, 342, 949–955. [Google Scholar] [CrossRef]
Treebak, J.T.; Pehmoller, C.; Kristensen, J.M.; Kjobsted, R.; Birk, J.B.; Schjerling, P.; Richter, E.A.; Goodyear, L.J.; Wojtaszewski, J.F. Acute exercise and physiological insulin induce distinct phosphorylation signatures on TBC1D1 and TBC1D4 proteins in human skeletal muscle. J. Physiol. 2014, 592, 351–375. [Google Scholar] [CrossRef]
Roepstorff, C.; Halberg, N.; Hillig, T.; Saha, A.K.; Ruderman, N.B.; Wojtaszewski, J.F.; Richter, E.A.; Kiens, B. Malonyl-CoA and carnitine in regulation of fat oxidation in human skeletal muscle during exercise. Am. J. Physiol. Endocrinol. Metab. 2005, 288, E133–E142. [Google Scholar] [CrossRef][Green Version]
Steinberg, G.R.; Watt, M.J.; McGee, S.L.; Chan, S.; Hargreaves, M.; Febbraio, M.A.; Stapleton, D.; Kemp, B.E. Reduced glycogen availability is associated with increased AMPKα2 activity, nuclear AMPKα2 protein abundance, and GLUT4 mRNA expression in contracting human skeletal muscle. Appl. Physiol. Nutr. Metab. 2006, 31, 302–312. [Google Scholar] [CrossRef][Green Version]
Wojtaszewski, J.F.; MacDonald, C.; Nielsen, J.N.; Hellsten, Y.; Hardie, D.G.; Kemp, B.E.; Kiens, B.; Richter, E.A. Regulation of 5′ AMP-activated protein kinase activity and substrate utilization in exercising human skeletal muscle. Am. J. Physiol. Endocrinol. Metab. 2003, 284, E813–E822. [Google Scholar] [CrossRef][Green Version]
Impey, S.G.; Hammond, K.M.; Shepherd, S.O.; Sharples, A.P.; Stewart, C.; Limb, M.; Smith, K.; Philp, A.; Jeromson, S.; Hamilton, D.L.; et al. Fuel for the work required: A practical approach to amalgamating train-low paradigms for endurance athletes. Physiol. Rep. 2016, 4. [Google Scholar] [CrossRef]
Hearris, M.A.; Hammond, K.M.; Seaborne, R.A.; Stocks, B.; Shepherd, S.O.; Philp, A.; Sharples, A.P.; Morton, J.P.; Louis, J.B. Graded reductions in preexercise muscle glycogen impair exercise capacity but do not augment skeletal muscle cell signaling: Implications for CHO periodization. J. Appl. Physiol. 2019, 126, 1587–1597. [Google Scholar] [CrossRef]
Hearris, M.A.; Owens, D.J.; Strauss, J.A.; Shepherd, S.O.; Sharples, A.P.; Morton, J.P.; Louis, J.B. Graded reductions in pre-exercise glycogen concentration do not augment exercise-induced nuclear AMPK and PGC-1α protein content in human muscle. Exp. Physiol. 2020. in Press. [Google Scholar] [CrossRef]
Stocks, B.; Dent, J.R.; Ogden, H.B.; Zemp, M.; Philp, A. Postexercise skeletal muscle signaling responses to moderate- to high-intensity steady-state exercise in the fed or fasted state. Am. J. Physiol. Endocrinol. Metab. 2019, 316, E230–E238. [Google Scholar] [CrossRef]
McConell, G.K.; Lee-Young, R.S.; Chen, Z.P.; Stepto, N.K.; Huynh, N.N.; Stephens, T.J.; Canny, B.J.; Kemp, B.E. Short-term exercise training in humans reduces AMPK signalling during prolonged exercise independent of muscle glycogen. J. Physiol. 2005, 568, 665–676. [Google Scholar] [CrossRef]
Mortensen, B.; Hingst, J.R.; Frederiksen, N.; Hansen, R.W.; Christiansen, C.S.; Iversen, N.; Friedrichsen, M.; Birk, J.B.; Pilegaard, H.; Hellsten, Y.; et al. Effect of birth weight and 12 weeks of exercise training on exercise-induced AMPK signaling in human skeletal muscle. Am. J. Physiol. Endocrinol. Metab. 2013, 304, E1379–E1390. [Google Scholar] [CrossRef] [PubMed][Green Version]
Guerra, B.; Guadalupe-Grau, A.; Fuentes, T.; Ponce-Gonzalez, J.G.; Morales-Alamo, D.; Olmedillas, H.; Guillen-Salgado, J.; Santana, A.; Calbet, J.A. SIRT1, AMP-activated protein kinase phosphorylation and downstream kinases in response to a single bout of sprint exercise: Influence of glucose ingestion. Eur. J. Appl. Physiol. 2010, 109, 731–743. [Google Scholar] [CrossRef] [PubMed]
Morton, J.P.; Croft, L.; Bartlett, J.D.; MacLaren, D.P.; Reilly, T.; Evans, L.; McArdle, A.; Drust, B. Reduced carbohydrate availability does not modulate training-induced heat shock protein adaptations but does upregulate oxidative enzyme activity in human skeletal muscle. J. Appl. Physiol. 2009, 106, 1513–1521. [Google Scholar] [CrossRef] [PubMed][Green Version]
Akerstrom, T.C.; Fischer, C.P.; Plomgaard, P.; Thomsen, C.; Van Hall, G.; Pedersen, B.K. Glucose ingestion during endurance training does not alter adaptation. J. Appl. Physiol. 2009, 106, 1771–1779. [Google Scholar] [CrossRef]
Islam, H.; Edgett, B.A.; Bonafiglia, J.T.; Shulman, T.; Ma, A.; Quadrilatero, J.; Simpson, C.A.; Gurd, B.J. Repeatability of exercise-induced changes in mRNA expression and technical considerations for qPCR analysis in human skeletal muscle. Exp. Physiol. 2019, 104, 407–420. [Google Scholar] [CrossRef]
Chin, E.R. The role of calcium and calcium/calmodulin-dependent kinases in skeletal muscle plasticity and mitochondrial biogenesis. Proc. Nutr. Soc. 2004, 63, 279–286. [Google Scholar] [CrossRef][Green Version]
Wright, D.C. Mechanisms of calcium-induced mitochondrial biogenesis and GLUT4 synthesis. Appl. Physiol. Nutr. Metab. 2007, 32, 840–845. [Google Scholar] [CrossRef]
Margolis, L.M.; Pasiakos, S.M. Optimizing intramuscular adaptations to aerobic exercise: Effects of carbohydrate restriction and protein supplementation on mitochondrial biogenesis. Adv. Nutr. 2013, 4, 657–664. [Google Scholar] [CrossRef][Green Version]
Jordy, A.B.; Kiens, B. Regulation of exercise-induced lipid metabolism in skeletal muscle. Exp. Physiol. 2014, 99, 1586–1592. [Google Scholar] [CrossRef][Green Version]
Yeo, W.K.; McGee, S.L.; Carey, A.L.; Paton, C.D.; Garnham, A.P.; Hargreaves, M.; Hawley, J.A. Acute signalling responses to intense endurance training commenced with low or normal muscle glycogen. Exp. Physiol. 2010, 95, 351–358. [Google Scholar] [CrossRef]
Cochran, A.J.; Little, J.P.; Tarnopolsky, M.A.; Gibala, M.J. Carbohydrate feeding during recovery alters the skeletal muscle metabolic response to repeated sessions of high-intensity interval exercise in humans. J. Appl. Physiol. 2010, 108, 628–636. [Google Scholar] [CrossRef] [PubMed][Green Version]
Chan, M.S.; McGee, S.L.; Watt, M.J.; Hargreaves, M.; Febbraio, M.A. Altering dietary nutrient intake that reduces glycogen content leads to phosphorylation of nuclear p38 MAP kinase in human skeletal muscle: Association with IL-6 gene transcription during contraction. FASEB J. 2004, 18, 1785–1787. [Google Scholar] [CrossRef] [PubMed]
Zbinden-Foncea, H.; Van Loon, L.J.; Raymackers, J.-M.; Francaux, M.; Deldicque, L. Contribution of nonesterified fatty acids to mitogen-activated protein kinase activation in human skeletal muscle during endurance exercise. Int. J. Sport Nutr. Exerc. Metab. 2013, 23, 201–209. [Google Scholar] [CrossRef] [PubMed]
Garcia-Roves, P.; Huss, J.M.; Han, D.H.; Hancock, C.R.; Iglesias-Gutierrez, E.; Chen, M.; Holloszy, J.O. Raising plasma fatty acid concentration induces increased biogenesis of mitochondria in skeletal muscle. Proc. Natl. Acad. Sci. USA 2007, 104, 10709–10713. [Google Scholar] [CrossRef][Green Version]
Fritzen, A.M.; Lundsgaard, A.M.; Kiens, B. Tuning fatty acid oxidation in skeletal muscle with dietary fat and exercise. Nat. Rev. Endocrinol. 2020, 16, 683–696. [Google Scholar] [CrossRef]
Gleeson, M.; Maughan, R.J.; Greenhaff, P.L. Comparison of the effects of pre-exercise feeding of glucose, glycerol and placebo on endurance and fuel homeostasis in man. Eur. J. Appl. Physiol. Occup. Physiol. 1986, 55, 645–653. [Google Scholar] [CrossRef]
Foster, C.; Costill, D.; Fink, W. Effects of preexercise feedings on endurance performance. Med. Sci. Sports 1979, 11, 1–5. [Google Scholar]
Febbraio, M.A.; Chiu, A.; Angus, D.J.; Arkinstall, M.J.; Hawley, J.A. Effects of carbohydrate ingestion before and during exercise on glucose kinetics and performance. J. Appl. Physiol. 2000, 89, 2220–2226. [Google Scholar] [CrossRef][Green Version]
Paul, D.; Jacobs, K.A.; Geor, R.J.; Hinchcliff, K.W. No effect of pre-exercise meal on substrate metabolism and time trial performance during intense endurance exercise. Int. J. Sport Nutr. Exerc. Metab. 2003, 13, 489–503. [Google Scholar] [CrossRef]
Margaritelis, N.V.; Paschalis, V.; Theodorou, A.A.; Kyparos, A.; Nikolaidis, M.G. Redox basis of exercise physiology. Redox Biol. 2020, 35, 101499. [Google Scholar] [CrossRef]
Gregersen, S.; Samocha-Bonet, D.; Heilbronn, L.K.; Campbell, L.V. Inflammatory and oxidative stress responses to high-carbohydrate and high-fat meals in healthy humans. J. Nutr. Metab. 2012, 2012, 238056. [Google Scholar] [CrossRef]
Margaritelis, N.V.; Theodorou, A.A.; Paschalis, V.; Veskoukis, A.S.; Dipla, K.; Zafeiridis, A.; Panayiotou, G.; Vrabas, I.S.; Kyparos, A.; Nikolaidis, M.G. Adaptations to endurance training depend on exercise-induced oxidative stress: Exploiting redox interindividual variability. Acta Physiol. 2018, 222, e12898. [Google Scholar] [CrossRef] [PubMed]
Henriquez-Olguin, C.; Renani, L.B.; Arab-Ceschia, L.; Raun, S.H.; Bhatia, A.; Li, Z.; Knudsen, J.R.; Holmdahl, R.; Jensen, T.E. Adaptations to high-intensity interval training in skeletal muscle require NADPH oxidase 2. Redox Biol. 2019, 24, 101188. [Google Scholar] [CrossRef] [PubMed]
Carnevale, R.; Pignatelli, P.; Nocella, C.; Loffredo, L.; Pastori, D.; Vicario, T.; Petruccioli, A.; Bartimoccia, S.; Violi, F. Extra virgin olive oil blunt post-prandial oxidative stress via NOX2 down-regulation. Atherosclerosis 2014, 235, 649–658. [Google Scholar] [CrossRef] [PubMed]
Nieman, D.C.; Gillitt, N.D.; Chen, G.-Y.; Zhang, Q.; Sha, W.; Kay, C.D.; Chandra, P.; Kay, K.L.; Lila, M.A. Blueberry and/or Banana Consumption Mitigate Arachidonic, Cytochrome P450 Oxylipin Generation During Recovery From 75-Km Cycling: A Randomized Trial. Front. Nutr. 2020, 7, 121. [Google Scholar] [CrossRef] [PubMed]
Chen, X.; Jia, G.; Liu, G.; Zhao, H.; Huang, Z. Effects of apple polyphenols on myofiber-type transformation in longissimus dorsi muscle of finishing pigs. Anim. Biotechnol. 2020, 1–8. [Google Scholar] [CrossRef] [PubMed]
Draganidis, D.; Karagounis, L.G.; Athanailidis, I.; Chatzinikolaou, A.; Jamurtas, A.Z.; Fatouros, I.G. Inflammaging and skeletal muscle: Can protein intake make a difference? J. Nutr. 2016, 146, 1940–1952. [Google Scholar] [CrossRef]
Cluberton, L.J.; McGee, S.L.; Murphy, R.M.; Hargreaves, M. Effect of carbohydrate ingestion on exercise-induced alterations in metabolic gene expression. J. Appl. Physiol. 2005, 99, 1359–1363. [Google Scholar] [CrossRef][Green Version]
Akerstrom, T.C.; Krogh-Madsen, R.; Petersen, A.M.; Pedersen, B.K. Glucose ingestion during endurance training in men attenuates expression of myokine receptor. Exp. Physiol. 2009, 94, 1124–1131. [Google Scholar] [CrossRef]
Spencer, M.K.; Yan, Z.; Katz, A. Carbohydrate supplementation attenuates IMP accumulation in human muscle during prolonged exercise. Am. J. Physiol. 1991, 261, C71–C76. [Google Scholar] [CrossRef]
Laursen, P.B. Training for intense exercise performance: High-intensity or high-volume training? Scand. J. Med. Sci. Sports 2010, 20 (Suppl. 2), 1–10. [Google Scholar] [CrossRef] [PubMed]
Combes, A.; Dekerle, J.; Webborn, N.; Watt, P.; Bougault, V.; Daussin, F.N. Exercise-induced metabolic fluctuations influence AMPK, p38-MAPK and CaMKII phosphorylation in human skeletal muscle. Physiol. Rep. 2015, 3, e12462. [Google Scholar] [CrossRef] [PubMed]
Chryssanthopoulos, C.; Williams, C.; Wilson, W.; Asher, L.; Hearne, L. Comparison between carbohydrate feedings before and during exercise on running performance during a 30-km treadmill time trial. Int. J. Sport Nutr. Exerc. Metab. 1994, 4, 374–386. [Google Scholar] [CrossRef] [PubMed][Green Version]
Burke, L.M.; Claassen, A.; Hawley, J.A.; Noakes, T.D. Carbohydrate intake during prolonged cycling minimizes effect of glycemic index of preexercise meal. J. Appl. Physiol. 1998, 85, 2220–2226. [Google Scholar] [CrossRef] [PubMed]
Rowlands, D.S.; Hopkins, W.G. Effect of high-fat, high-carbohydrate, and high-protein meals on metabolism and performance during endurance cycling. Int. J. Sport Nutr. Exerc. Metab. 2002, 12, 318–335. [Google Scholar] [CrossRef]
Learsi, S.K.; Ghiarone, T.; Silva-Cavalcante, M.D.; Andrade-Souza, V.A.; Ataide-Silva, T.; Bertuzzi, R.; de Araujo, G.G.; McConell, G.; Lima-Silva, A.E. Cycling time trial performance is improved by carbohydrate ingestion during exercise regardless of a fed or fasted state. Scand. J. Med. Sci. Sports 2019, 29, 651–662. [Google Scholar] [CrossRef]
Little, J.P.; Chilibeck, P.D.; Ciona, D.; Vandenberg, A.; Zello, G.A. The effects of low- and high-glycemic index foods on high-intensity intermittent exercise. Int. J. Sports Physiol. Perform. 2009, 4, 367–380. [Google Scholar] [CrossRef][Green Version]
Coffey, V.G.; Moore, D.R.; Burd, N.A.; Rerecich, T.; Stellingwerff, T.; Garnham, A.P.; Phillips, S.M.; Hawley, J.A. Nutrient provision increases signalling and protein synthesis in human skeletal muscle after repeated sprints. Eur. J. Appl. Physiol. 2011, 111, 1473–1483. [Google Scholar] [CrossRef]
Pritchett, K.; Bishop, P.; Pritchett, R.; Kovacs, M.; Davis, J.; Casaru, C.; Green, M. Effects of timing of pre-exercise nutrient intake on glucose responses and intermittent cycling performance. S. Afr. J. Sports Med. 2008, 20, 86–90. [Google Scholar] [CrossRef]
Astorino, T.A.; Sherrick, S.; Mariscal, M.; Jimenez, V.C.; Stetson, K.; Courtney, D. No effect of meal intake on physiological or perceptual responses to self-selected high intensity interval exercise (HIIE). Biol. Sport 2019, 36, 225. [Google Scholar] [CrossRef]
Murakami, I.; Sakuragi, T.; Uemura, H.; Menda, H.; Shindo, M.; Tanaka, H. Significant effect of a pre-exercise high-fat meal after a 3-day high-carbohydrate diet on endurance performance. Nutrients 2012, 4, 625–637. [Google Scholar] [CrossRef] [PubMed][Green Version]
Burdon, C.A.; Spronk, I.; Cheng, H.L.; O’Connor, H.T. Effect of Glycemic Index of a Pre-exercise Meal on Endurance Exercise Performance: A Systematic Review and Meta-analysis. Sports Med. 2017, 47, 1087–1101. [Google Scholar] [CrossRef] [PubMed]
Kern, M.; Heslin, C.J.; Rezende, R.S. Metabolic and performance effects of raisins versus sports gel as pre-exercise feedings in cyclists. J. Strength Cond. Res. 2007, 21, 1204–1207. [Google Scholar] [PubMed]
Campbell, C.; Prince, D.; Braun, M.; Applegate, E.; Casazza, G.A. Carbohydrate-supplement form and exercise performance. Int. J. Sport Nutr. Exerc. Metab. 2008, 18, 179–190. [Google Scholar] [CrossRef] [PubMed]
Cramer, M.J.; Dumke, C.L.; Hailes, W.S.; Cuddy, J.S.; Ruby, B.C. Postexercise Glycogen Recovery and Exercise Performance is Not Significantly Different Between Fast Food and Sport Supplements. Int. J. Sport Nutr. Exerc. Metab. 2015, 25, 448–455. [Google Scholar] [CrossRef]
Jeukendrup, A.E.; Killer, S.C. The myths surrounding pre-exercise carbohydrate feeding. Ann. Nutr. Metab. 2010, 57 (Suppl. 2), 18–25. [Google Scholar] [CrossRef]
Mears, S.A.; Dickinson, K.; Bergin-Taylor, K.; Dee, R.; Kay, J.; James, L.J. Perception of Breakfast Ingestion Enhances High-Intensity Cycling Performance. Int. J. Sports Physiol. Perform. 2018, 13, 504–509. [Google Scholar] [CrossRef][Green Version]
Clark, V.R.; Hopkins, W.G.; Hawley, J.A.; Burke, L.M. Placebo effect of carbohydrate feedings during a 40-km cycling time trial. Med. Sci. Sports Exerc. 2000, 32, 1642–1647. [Google Scholar] [CrossRef]
Hulston, C.J.; Jeukendrup, A.E. No placebo effect from carbohydrate intake during prolonged exercise. Int. J. Sport Nutr. Exerc. Metab. 2009, 19, 275–284. [Google Scholar] [CrossRef]
Waterworth, S.P.; Spencer, C.C.; Porter, A.L.; Morton, J.P. Perception of Carbohydrate Availability Augments High-Intensity Intermittent Exercise Capacity Under Sleep-Low, Train-Low Conditions. Int. J. Sport Nutr. Exerc. Metab. 2020, 30, 105–111. [Google Scholar] [CrossRef]
Riis, S.; Moller, A.B.; Dollerup, O.; Hoffner, L.; Jessen, N.; Madsen, K. Acute and sustained effects of a periodized carbohydrate intake using the sleep-low model in endurance-trained males. Scand. J. Med. Sci. Sports 2019, 29, 1866–1880. [Google Scholar] [CrossRef] [PubMed]
Marquet, L.-A.; Brisswalter, J.; Louis, J.; Tiollier, E.; Burke, L.; Hawley, J.; Hausswirth, C. Enhanced Endurance Performance by Periodization of CHO Intake:” sleep low” strategy. Med. Sci. Sports Exerc. 2016, 48, 663–672. [Google Scholar] [CrossRef] [PubMed]
Gillen, J.B.; Percival, M.E.; Ludzki, A.; Tarnopolsky, M.A.; Gibala, M. Interval training in the fed or fasted state improves body composition and muscle oxidative capacity in overweight women. Obesity 2013, 21, 2249–2255. [Google Scholar] [CrossRef] [PubMed]
Terada, T.; Toghi Eshghi, S.R.; Liubaoerjijin, Y.; Kennedy, M.; Myette-Cote, E.; Fletcher, K.; Boule, N.G. Overnight fasting compromises exercise intensity and volume during sprint interval training but improves high-intensity aerobic endurance. J. Sports Med. Phys. Fit. 2019, 59, 357–365. [Google Scholar] [CrossRef]
Van Proeyen, K.; Szlufcik, K.; Nielens, H.; Ramaekers, M.; Hespel, P. Beneficial metabolic adaptations due to endurance exercise training in the fasted state. J. Appl. Physiol. 2011, 110, 236–245. [Google Scholar] [CrossRef][Green Version]
Nybo, L.; Pedersen, K.; Christensen, B.; Aagaard, P.; Brandt, N.; Kiens, B. Impact of carbohydrate supplementation during endurance training on glycogen storage and performance. Acta Physiol. 2009, 197, 117–127. [Google Scholar] [CrossRef]
Beaudouin, F.; Joerg, F.; Hilpert, A.; Meyer, T.; Hecksteden, A. Carbohydrate intake and training efficacy—a randomized cross-over study. J. Sports Sci. 2018, 36, 942–948. [Google Scholar] [CrossRef]
Marquet, L.A.; Hausswirth, C.; Molle, O.; Hawley, J.A.; Burke, L.M.; Tiollier, E.; Brisswalter, J. Periodization of Carbohydrate Intake: Short-Term Effect on Performance. Nutrients 2016, 8, 755. [Google Scholar] [CrossRef][Green Version]
Hulston, C.J.; Venables, M.C.; Mann, C.H.; Martin, C.; Philp, A.; Baar, K.; Jeukendrup, A.E. Training with low muscle glycogen enhances fat metabolism in well-trained cyclists. Med. Sci. Sports Exerc. 2010, 42, 2046–2055. [Google Scholar] [CrossRef][Green Version]
Yeo, W.K.; Paton, C.D.; Garnham, A.P.; Burke, L.M.; Carey, A.L.; Hawley, J.A. Skeletal muscle adaptation and performance responses to once a day versus twice every second day endurance training regimens. J. Appl. Physiol. 2008, 105, 1462–1470. [Google Scholar] [CrossRef][Green Version]
Cochran, C.A.J.R.; Myslik, F.; MacInnis, M.J.; Percival, M.E.; Bishop, D.; Tarnopolsky, M.A.; Gibala, M.J. Manipulating carbohydrate availability between twice-daily sessions of high-intensity interval training over 2 weeks improves time-trial performance. Int. J. Sport Nutr. Exerc. Metab. 2015, 25, 463–470. [Google Scholar] [CrossRef] [PubMed]
Ghiarone, T.; Andrade-Souza, V.A.; Learsi, S.K.; Tomazini, F.; Ataide-Silva, T.; Sansonio, A.; Fernandes, M.P.; Saraiva, K.L.; Figueiredo, R.C.; Tourneur, Y. Twice-a-day training improves mitochondrial efficiency, but not mitochondrial biogenesis, compared with once-daily training. J. Appl. Physiol. 2019, 127, 713–725. [Google Scholar] [CrossRef] [PubMed]
Gejl, K.D.; Thams, L.B.; Hansen, M.; Rokkedal-Lausch, T.; Plomgaard, P.; Nybo, L.; Larsen, F.J.; Cardinale, D.A.; Jensen, K.; Holmberg, H.-C. No Superior Adaptations to Carbohydrate Periodization in Elite Endurance Athletes. Med. Sci. Sports Exerc. 2017, 49, 2486–2497. [Google Scholar] [CrossRef] [PubMed][Green Version]
Holloszy, J.O.; Coyle, E.F. Adaptations of skeletal muscle to endurance exercise and their metabolic consequences. J. Appl. Physiol. Respir. Environ. Exerc. Physiol. 1984, 56, 831–838. [Google Scholar] [CrossRef] [PubMed]
Larsen, S.; Nielsen, J.; Hansen, C.N.; Nielsen, L.B.; Wibrand, F.; Stride, N.; Schroder, H.D.; Boushel, R.; Helge, J.W.; Dela, F.; et al. Biomarkers of mitochondrial content in skeletal muscle of healthy young human subjects. J. Physiol. 2012, 590, 3349–3360. [Google Scholar] [CrossRef]
Andrade-Souza, V.A.; Ghiarone, T.; Sansonio, A.; Santos Silva, K.A.; Tomazini, F.; Arcoverde, L.; Fyfe, J.; Perri, E.; Saner, N.; Kuang, J.; et al. Exercise twice-a-day potentiates markers of mitochondrial biogenesis in men. FASEB J. 2020, 34, 1602–1619. [Google Scholar] [CrossRef][Green Version]
Charlot, K.; Pichon, A.; Chapelot, D. Effets de l’entraînement à jeun sur la V˙ O2max, l’oxydation des lipides et la performance aérobie chez des jeunes hommes modérément entraînés. Sci. Sports 2016, 31, 166–171. [Google Scholar] [CrossRef]
Burke, L.M.; Ross, M.L.; Garvican-Lewis, L.A.; Welvaert, M.; Heikura, I.A.; Forbes, S.G.; Mirtschin, J.G.; Cato, L.E.; Strobel, N.; Sharma, A.P.; et al. Low carbohydrate, high fat diet impairs exercise economy and negates the performance benefit from intensified training in elite race walkers. J. Physiol. 2017, 595, 2785–2807. [Google Scholar] [CrossRef][Green Version]
Burke, L.M.; Sharma, A.P.; Heikura, I.A.; Forbes, S.F.; Holloway, M.; McKay, A.K.A.; Bone, J.L.; Leckey, J.J.; Welvaert, M.; Ross, M.L. Crisis of confidence averted: Impairment of exercise economy and performance in elite race walkers by ketogenic low carbohydrate, high fat (LCHF) diet is reproducible. PLoS ONE 2020, 15, e0234027. [Google Scholar] [CrossRef]
Lundby, C.; Montero, D.; Joyner, M. Biology of VO2max: Looking under the physiology lamp. J. Acta Physiol. 2017, 220, 218–228. [Google Scholar] [CrossRef]
Impey, S.G.; Hearris, M.A.; Hammond, K.M.; Bartlett, J.D.; Louis, J.; Close, G.L.; Morton, J.P. Fuel for the work required: A theoretical framework for carbohydrate periodization and the glycogen threshold hypothesis. Sports Med. 2018, 48, 1031–1048. [Google Scholar] [CrossRef] [PubMed][Green Version]
Van Proeyen, K.; Szlufcik, K.; Nielens, H.; Deldicque, L.; Van Dyck, R.; Ramaekers, M.; Hespel, P. High-fat diet overrules the effects of training on fiber-specific intramyocellular lipid utilization during exercise. J. Appl. Physiol. (1985) 2011, 111, 108–116. [Google Scholar] [CrossRef] [PubMed][Green Version]
Durkalec-Michalski, K.; Zawieja, E.E.; Zawieja, B.E.; Jurkowska, D.; Buchowski, M.S.; Jeszka, J. Effects of Low Versus Moderate Glycemic Index Diets on Aerobic Capacity in Endurance Runners: Three-Week Randomized Controlled Crossover Trial. Nutrients 2018, 10, 370. [Google Scholar] [CrossRef] [PubMed][Green Version]
Podlogar, T.; Free, B.; Wallis, G.A. High rates of fat oxidation are maintained after the sleep low approach despite delayed carbohydrate feeding during exercise. Eur. J. Sport Sci. 2020, 1–11. [Google Scholar] [CrossRef] [PubMed]
Heikura, I.A.; Stellingwerff, T.; Burke, L.M. Self-reported periodization of nutrition in elite female and male runners and race walkers. Front. Physiol. 2018, 9, 1732. [Google Scholar] [CrossRef] [PubMed]