Αξίζει η προπόνηση σε καθεστώς νηστείας; Οι διαφορές στην απόδοση και οι προσαρμογές στη μέγιστη αερόβια ικανότητα (Μέρος Β’)
Runbeat Team 13:35 24-01-2023

Στο δεύτερο μέρος για τα συμπεράσματα που έχουν προκύψει από την μετα-ανάλυση 165 μελετών στην οποία προχώρησε ομάδα του Πανεπιστημίου του Ώκλαντ στη Νέα Ζηλανδία, θα εστιάσουμε σε κάποια επιπλέον σημεία που παρουσιάζουν εξαιρετικό ενδιαφέρον και ίσως απαντούν και σε πολλές απορίες ή στη σύγχυση που δημιουργείται πολλές φορές για το τι είναι σωστό και τι είναι λάθος. Στο πρώτο μέρος «Διατροφή πριν από την προπόνηση αντοχής» είδαμε τις βασικές αρχές στις οποίες κατέληξαν οι επιστήμονες από την επεξεργασία στοιχείων που έχουν προκύψει από την τεράστια βάση δεδομένων που έχει πλέον δημιουργηθεί λόγω του πλήθους των σχετικών μελετών.
Η «παγίδα» να τρέχεις άδειος ενεργειακά
Παρά το γεγονός ότι μεγάλος αριθμός αθλητών αντοχής εκτελούν προπόνηση σε κατάσταση νηστείας, υπάρχουν πιθανές αρνητικές επιπτώσεις από τη χρήση της. Ιδιαίτερα για τους αθλητές που κάνουν μεγάλο όγκο προπόνησης, η άσκηση σε ολονύκτια νηστεία θα μπορούσε πιθανότερο να οδηγήσει σε αρνητικό ενεργειακό ισοζύγιο, το οποίο μπορεί να συσχετιστεί με ορμονική και ανοσοποιητική δυσλειτουργία.
Ως μέθοδος παροχής ενεργειακής πρόσληψης, επιτρέποντας παράλληλα υψηλότερα επίπεδα οξείδωσης λίπους, θα είχε εξαιρετικό ενδιαφέρον στο μέλλον να εξεταστούν οι επιπτώσεις ενός πρωινού πλούσιου σε πρωτεΐνες στην οξείδωση του λίπους κατά τη διάρκεια της άσκησης, σε άμεση σύγκριση με την άσκηση μετά από ένα πρωινό πλούσιο σε CHO και κατά τη διάρκεια της νύχτας. κατάσταση νηστείας. Καθώς αυτή η προσέγγιση χρησιμοποιείται επί του παρόντος από λίγους αθλητές αντοχής, θα μπορούσε να είναι ένα χρήσιμο εργαλείο για όσους θέλουν να αυξήσουν την καύση λίπους χωρίς να υποστούν μεγάλο θερμιδικό έλλειμμα.
Η επίδραση των διάφορων γευμάτων πριν από την άσκηση στην άνεση του εντέρου θα πρέπει επίσης να διερευνηθεί, καθώς ένας μεγάλος αριθμός αθλητών εκτελούν προπόνηση σε κατάσταση νηστείας για να αποφύγουν τη δυσφορία του εντέρου .
Οξειδωτικό στρες και είδη τροφής
Το οξειδωτικό στρες των μυών διαδραματίζει άμεσο ρόλο στη ρύθμιση της ανταπόκρισης τόσο στην οξεία άσκηση (π.χ. μυϊκή συσταλτική λειτουργία, πρόσληψη γλυκόζης, ροή αίματος και κυτταρική βιοενέργεια) όσο και στη μακροχρόνια προπόνηση άσκησης (π.χ. μιτοχονδριακή βιογένεση, μυϊκή υπερτροφία, αγγειογένεση και ομοιόσταση οξειδοαναγωγής) . Υπάρχει πολύ μικρή έρευνα που εξετάζει την επίδραση ενός γεύματος πριν από την άσκηση στην απόκριση του οξειδωτικού στρες σε μια περίοδο άσκησης. Σε κατάσταση ηρεμίας, ένα γεύμα υψηλής περιεκτικότητας σε CHO(υδατάνθρακας) μπορεί να προκαλέσει μεγαλύτερη απόκριση μεταγευματικού οξειδωτικού στρες σε σύγκριση με ένα γεύμα υψηλής περιεκτικότητας σε λιπαρά, ενώ η προσθήκη ελαιολάδου σε ένα γεύμα εμφανίζεται να μειώνει μετά το γεύμα τις αυξήσεις στους δείκτες οξειδωτικού στρες, όπως η οξειδάση NADPH και 8-ισοπροστανη, τα οποία και τα δύο έχουν συσχετιστεί με προσαρμογές προπόνησης αντοχής.
Η μεγάλη και χρόνια κατανάλωση φρούτων μπορεί να μειώσει την οξείδωση των λιπιδίων κατά τη διάρκεια της άσκησης και οι φαινολικές ενώσεις που προέρχονται από φρούτα μπορεί να προάγουν τον μετασχηματισμό τύπου μυϊκής ίνας . Η πρωτεΐνη ορού γάλακτος μπορεί επίσης να επηρεάσει το αντιοξειδωτικό αμυντικό σύστημα ενισχύοντας τη δραστηριότητα των ενδογενών αντιοξειδωτικών ενζύμων. Είναι προς το παρόν άγνωστο πώς διάφορα γεύματα πριν από την άσκηση επηρεάζουν το οξειδωτικό στρες ως απόκριση στην άσκηση και εάν υπάρχουν μακροπρόθεσμες προπονητικές επιπτώσεις.
Οι υδατάνθρακες σε Long run και διαλειμματική προπόνηση
Η κατανάλωση CHO πριν από την άσκηση έχει βρεθεί ότι γενικά ενισχύει την απόδοση παρατεταμένης (>60 λεπτά), αλλά όχι μικρότερης διάρκειας αερόβιας άσκησης κάτω από μια ώρα. Ωστόσο, η λήψη CHO κατά τη διάρκεια της άσκησης ελαχιστοποιεί τις διαφορές μεταξύ της κατανάλωσης CHO όπως διαπιστώθηκε έναντι ενός εικονικού φαρμάκου πριν από την άσκηση. Η συντριπτική πλειονότητα των μελετών που συγκρίνουν την απόδοση σε κατάσταση σίτισης ή νηστείας έχουν χρησιμοποιήσει άσκηση αντοχής σε σταθερή κατάσταση , αλλά παρόμοια αποτελέσματα της διάρκειας άσκησης διαπιστώνονται με τη προπόνηση υψηλής έντασης(HIIT/ High-Intensity Interval Training), καθώς η απόδοση βελτιώθηκε στην κατάσταση προπόνησης σε υψηλή σίτισης για 90 λεπτά υψηλής έντασης διακοπτόμενο τρέξιμο (διαλειμματική), αλλά όχι HIIT μικρής διάρκειας.
Ωστόσο, μια μελέτη έδειξε ένα όφελος από την κατανάλωση CHO πριν από την άσκηση σε ένα αγωνιστικό τεστ διάρκειας ~8–10 λεπτών . Αρκετές μελέτες έχουν συγκρίνει γεύματα με υψηλή περιεκτικότητα σε λιπαρά και υψηλή περιεκτικότητα σε CHO πριν από την άσκηση με ελάχιστες διαφορές απόδοσης που παρατηρήθηκαν .
Ποσότητα και τύπος γεύματος πριν την άσκηση
Η ποσότητα CHO (25gr–310 gr) που καταναλώνεται πριν από την άσκηση δεν έχει σημαντική επίδραση στην απόδοση της χρονομέτρησης ενώ ο γλυκαιμικός δείκτης φαίνεται να έχει μόνο μια μικρή επίδραση που είναι πιο πιθανό να παρατηρηθεί σε δοκιμές απόδοσης χρόνου έως εξάντλησης, αλλά όχι σε δοκιμές απόδοσης χρονικής δοκιμής. Δεν έχουν παρατηρηθεί διαφορές στην απόδοση μετά από κατάποση στερεού έναντι υγρού υδατάνθρακα CHO πριν από την άσκηση, CHO με βάση τα τζελ ή συμπληρωμάτων γρήγορου φαγητού έναντι αθλητικού ποτού. Συνολικά, η άσκηση με τροφοδότηση έναντι νηστείας φαίνεται να έχει πολύ μεγαλύτερη επίδραση στην απόδοση της άσκησης από την ποσότητα ή το χρόνο των γευμάτων, εκτός εάν η διαφορά στον χρόνο των γευμάτων είναι τουλάχιστον 90 λεπτά. Υπάρχει κάποιος φόβος υπογλυκαιμίας από την κατανάλωση CHO μεταξύ 30-60 λεπτών πριν από την άσκηση. Ωστόσο, παρά το γεγονός ότι συμβαίνει σε μικρό αριθμό περιπτώσεων, δεν φαίνεται να υπάρχουν επιζήμιες επιδράσεις ή σχέση μεταξύ των χαμηλών συγκεντρώσεων γλυκόζης στο αίμα και της απόδοσης.
Αντιλήψεις και συμπεριφορά Αθλητών
Η αντίληψη του πρωινού λαμβάνεται επίσης υπόψη κατά τη σύγκριση των οξέων επιδράσεων απόδοσης της πρόσληψης CHO πριν από την άσκηση και της άσκησης σε νηστεία. Προπονημένοι ποδηλάτες ολοκλήρωσαν μια χρονομέτρηση ποδηλασίας ~20 λεπτών πιο γρήγορα όταν αντιλήφθηκαν ότι είχαν καταναλώσει πρωινό (CHO ή εικονικό φάρμακο) πριν από την έναρξη της άσκησης, σε σύγκριση με μια συνεδρία άσκησης σε νηστεία και υπήρξε 4% βελτίωση της απόδοσης χρονοδοκιμών ~ 1 ώρας όταν ενημερώθηκαν οι ποδηλάτες ότι το ρόφημα εικονικού φαρμάκου περιείχε στην πραγματικότητα CHO σε σύγκριση με μια τυφλή δοκιμή ! Ωστόσο, όταν προηγήθηκε μια χρονοδοκιμή από 2 ώρες ποδηλασίας σε σταθερή κατάσταση, δεν παρατηρήθηκαν επιδράσεις εικονικού φαρμάκου, υποδηλώνοντας ότι τα αποτελέσματα εικονικού φαρμάκου μπορεί να ελαχιστοποιηθούν με μεγαλύτερες διάρκειας άσκησης. Κατά την άσκηση με μειωμένα επίπεδα μυϊκού γλυκογόνου, η αντίληψη της διαθεσιμότητας CHO αύξησε την ικανότητα HIIT, αν και η απόδοση δεν αποκαταστάθηκε σε αυτήν της κατανάλωσης CHO . Σε μια έρευνα αθλητών αντοχής, το 26% συμφώνησε και το 51% διαφώνησε με τη δήλωση ότι, «η ποιότητα της προπόνησής μου είναι η ίδια είτε τρώω είτε δεν τρώω πριν την προπόνηση» , καθιστώντας πιθανό μια μεγάλη παραλλαγή μεταξύ των ατόμων υπάρχει σε σχέση με την αντίληψη του πρωινού και την επιρροή του στην απόδοση.
Προσαρμογές προπόνησης βάσει των υδατανθράκων
Η πλειονότητα της έρευνας που εξετάζει τις διατροφικές παρεμβάσεις πριν από την άσκηση έχει σχέση με μία μόνο συνεδρία άσκησης, με πολύ λιγότερες μελέτες να εξετάζουν τον αντίκτυπο στις προσαρμογές της προπόνησης. Αυτό είναι σχετικό επειδή οι οξείες αντιδράσεις στην άσκηση δεν αντιστοιχούν πάντα με μακροπρόθεσμες προσαρμογές. Για παράδειγμα, η αυξημένη οξείδωση του λίπους που παρατηρείται κατά την προπόνηση με χαμηλή έναντι υψηλής διαθεσιμότητας CHO δεν μεταφράζεται σε μακροπρόθεσμες αυξήσεις στην ικανότητα καύσης λίπους. Ομοίως, η άμβλυνση των βασικών μιτοχονδριακών πρωτεϊνών σηματοδότησης με την κατάποση CHO κατά τη διάρκεια της οξείας άσκησης δεν επηρέασε τις προκαλούμενες από την προπόνηση βελτιώσεις στην απόδοση ή τη μιτοχονδριακή βιογένεση. Ως εκ τούτου, είναι σημαντικό να κατανοήσουμε τις αλλαγές που συμβαίνουν με τη χρόνια προπόνηση και όχι με μια οξεία περίοδο άσκησης και μόνο.
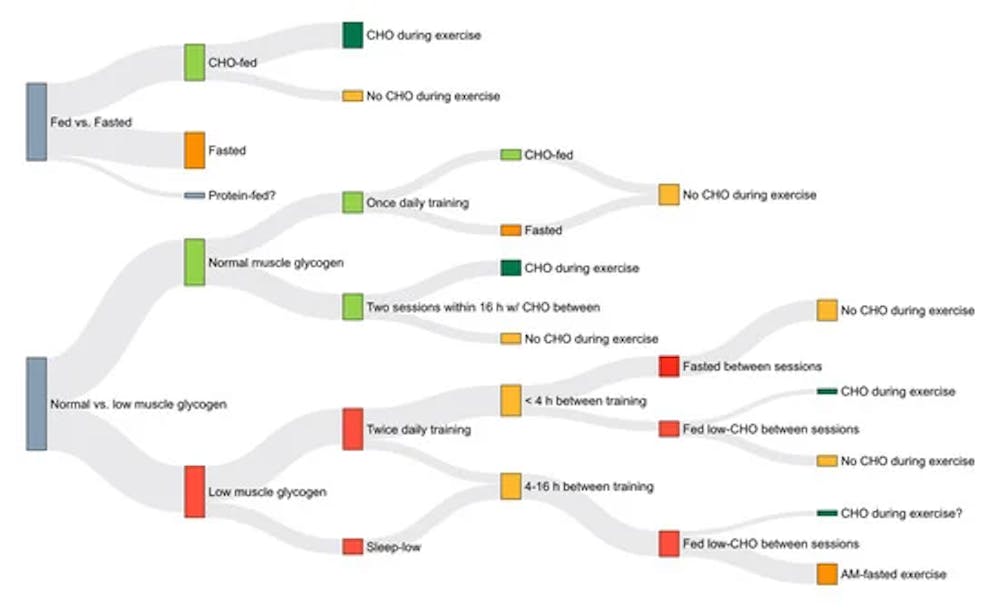
Σύγκριση των διαφόρων μεθόδων αλλαγής της διαθεσιμότητας CHO που χρησιμοποιούνται σε μελέτες. Τα πρωτόκολλα που χρησιμοποιούνται για την έναρξη της προπόνησης με μειωμένη διαθεσιμότητα ενδογενών υδατανθράκων περιλαμβάνουν ολονύκτια νηστεία και προπόνηση δύο φορές μέσα σε μια περίοδο 24 ωρών καταναλώνοντας διατροφή χαμηλής περιεκτικότητας σε CHO μεταξύ των συνεδριών ή παραμονής σε κατάσταση νηστείας. Ορισμένες μελέτες έχουν τροφοδοτήσει υδατάνθρακες κατά τη διάρκεια της άσκησης, ενώ άλλες όχι. Το πάχος της γραμμής σχετίζεται με τον αριθμό των μελετών που χρησιμοποιούν μια δεδομένη προσέγγιση. Τα ερωτηματικά αντιπροσωπεύουν τομείς που δεν έχουν ακόμη μελετηθεί. Περιελάμβανε 307 συμμετέχοντες (10,7% γυναίκες), 26,3 ± 4,2 mx1 − 26,3 ± 2,2 m x 1, V3O, ± 2,2 m x 1, ± 1,5 kg.
Αξίζει η προπόνηση σε καθεστώς νηστείας;
Ένας από τους λόγους που οι αθλητές εκτελούν προπονήσεις σε κατάσταση νηστείας είναι η επιθυμία τους να αυξήσουν την οξείδωση του λίπους κατά τη διάρκεια της άσκησης. Όπως έχουμε ήδη δει, η οξείδωση του λίπους είναι υψηλότερη κατά τη διάρκεια μιας οξείας περιόδου άσκησης που εκτελείται σε ολονύκτια νηστεία, σε σύγκριση με την κατάσταση σίτισης με CHO και με χαμηλό σε σύγκριση με υψηλό μυϊκό γλυκογόνο.
Παρά αυτές τις διαφορές, οι περισσότερες μελέτες δεν βρήκαν διαφορές στην οξείδωση του λίπους μετά από 4-6 εβδομάδες προπόνησης με σίτιση ή κατάσταση νηστείας όταν δοκιμάστηκαν σε κατάσταση σίτισης ή νηστείας . Παρόμοια ευρήματα έχουν αναφερθεί στο πλαίσιο «χαμηλού ύπνου», όπου η οξείδωση του λίπους αυξάνεται κατά τη διάρκεια των προπονήσεων νηστείας που εκτελούνται με χαμηλό μυϊκό γλυκογόνο σε σύγκριση με την άσκηση στην κατάσταση σίτισης, αλλά δεν παρατηρήθηκαν διαφορές στην οξείδωση του λίπους μετά από μία, τρεις ή τέσσερις εβδομάδες προπόνησης όταν δοκιμάστηκαν στην κατάσταση σίτισης.
Ωστόσο, είναι πιθανό να χρειαστούν μεγαλύτερες χρονικές περίοδοι προπόνησης σε νηστεία προτού παρατηρηθούν σχετικές διαφορές στην οξείδωση του λίπους, καθώς οι πρωτεΐνες που εμπλέκονται στην οξείδωση του λίπους έχουν αυξηθεί μετά από προπόνηση σε νηστεία, αλλά όχι σε κατάσταση σίτισης . Μελέτες που ανέφεραν βελτιώσεις στην οξείδωση του λίπους μετά από προπόνηση με άτομα που δοκιμάστηκαν σε φυσιολογικό μυϊκό γλυκογόνο σε κατάσταση νηστείας και προπονήθηκαν δύο φορές την ημέρα μόνο με νερό μεταξύ των συνεδριών. Αν και πρόκειται για εικασίες, αυτές οι διαφορές θα μπορούσαν να σχετίζονται με τη σηματοδότηση FFA, η οποία αυξάνεται κατά τη διάρκεια της άσκησης και αυξάνεται ακόμη περισσότερο εάν δεν καταναλωθεί τροφή τις ώρες μετά την άσκηση.
Τέλος, η χρήση IMTG (πρόκειται για την αποθήκευση λίπους και υδατανθράκων στις μυϊκές ίνες ως ενδομυϊκή τριακυλογλυκερόλη (IMTG) και γλυκογόνο, αντίστοιχα, και ως λιπώδης τριακυλογλυκερόλη και γλυκογόνο ήπατος, τα οποία μεταφέρονται στους σκελετικούς μύες ως λιπαρά οξέα χωρίς πλάσμα (FFAs) και γλυκόζη μέσω της κυκλοφορίας του αίματος) κατά τη διάρκεια της άσκησης αυξήθηκε μετά από 6 εβδομάδες προπόνησης σε νηστεία (αλλά όχι με σίτιση) όταν δοκιμάστηκε σε κατάσταση νηστείας, αλλά δεν υπήρχαν διαφορές όταν δοκιμάστηκε σε κατάσταση σίτισης, ενώ παρείχε επιπλέον CHO.
Συνολικά, φαίνεται ότι οι αυξήσεις στην οξείδωση του λίπους μετά από προπόνηση σε κατάσταση νηστείας ή χαμηλής περιεκτικότητας σε γλυκογόνο μπορεί να μην είναι σχετικές κατά τη διάρκεια τυπικών συνθηκών αγώνων κατά την κατανάλωση CHO πριν και κατά τη διάρκεια της άσκησης, αλλά σίγουρα απαιτούνται περισσότερες μελέτες σε αθλητές που προπονούνται σε αντοχή για να συγκριθούν οι οξείες και οι χρόνιες αλλαγές.
Προσαρμογές στη μέγιστη αερόβια ικανότητα
Μελέτες που συνέκριναν προπόνηση σε νηστεία και σίτιση δεν ανέφεραν διαφορές στο VO2max μετά από 4 εβδομάδες διαλειμματικής προπόνησης σπριντ, 6 εβδομάδες αερόβιας προπόνησης και 3 εβδομάδες προπόνησης μικτής έντασης. Ωστόσο, έχουν επίσης αναφερθεί μεγαλύτερες αυξήσεις στη VO2max που προκαλούνται από την προπόνηση μετά από προπόνηση σε νηστεία έναντι κατάστασης νηστείας και προπόνηση σε σίτιση έναντι κατάστασης νηστείας . Οι λόγοι για αυτά τα αποκλίνοντα ευρήματα είναι ασαφείς, καθώς και οι δύο μελέτες χρησιμοποίησαν μη προπονημένους συμμετέχοντες που εκτέλεσαν 4-6 εβδομάδες αερόβιας προπόνησης σε σταθερή κατάσταση. Παρόμοιες βελτιώσεις στη VO2max και στη μέγιστη ισχύ παρατηρήθηκαν σε μη προπονημένους άνδρες μετά από 8 εβδομάδες HIIT με ή χωρίς προηγούμενη κατανάλωση CHO και μετά από άσκηση που πραγματοποιήθηκε με χαμηλά ή υψηλά επίπεδα μυϊκού γλυκογόνου σε προπονημένους και μη προπονημένους αθλητές.
Η πρόσληψη διατροφής πριν από την άσκηση δεν έδειξε να έχει επίδραση στη VO2max (η οποία επηρεάζεται σε μεγάλο βαθμό από τις κεντρικές προσαρμογές), αλλά μπορεί να επηρεάσει τις περιφερειακές προσαρμογές που επηρεάζονται από τη διαθεσιμότητα καυσίμου όπως η χρήση του υποστρώματος και το μέγεθος των μιτοχονδρίων, ιδιαίτερα σε μη προπονημένους . Παρόλο που υπάρχει κάποια πιθανότητα η πρόσληψη διατροφής πριν από την άσκηση να επηρεάσει τις προσαρμογές στην προπόνηση αντοχής, η έλλειψη έρευνας σε άτομα που προπονούνται στην αντοχή, οι πολύ μεγάλες ποσότητες CHO που προσλαμβάνεται πριν από την άσκηση σε ορισμένες μελέτες και η παροχή CHO τόσο πριν όσο και κατά τη διάρκεια της άσκησης σε άλλες μελέτες κατέστησε δύσκολη την προέκταση των αποτελεσμάτων σε προπονημένους αθλητές.
Οι διαφορές στην απόδοση
Μελέτες που συνέκριναν προπόνηση με σίτιση και νηστεία έχουν αναφέρει παρόμοιες βελτιώσεις στον χρόνο μέχρι την εξάντληση κατά τη διάρκεια μιας μέγιστης αυξητικής δοκιμασίας και επίδοσης χρονοδοκιμής 1 ώρας μετά από 6 εβδομάδες προπόνησης αντοχής. Αντίθετα, ο χρόνος μέχρι την κούραση στο 85% της VO2max βελτιώθηκε περισσότερο σε εκπαιδευμένους ποδηλάτες που εκτελούσαν SIT σε κατάσταση νηστείας σε σύγκριση με αυτούς που κατανάλωναν CHO (>2,5 g kg−1 CHO πριν και ποτό CHO κατά τη διάρκεια της άσκησης), παρά το γεγονός ότι εκτελούσαν λιγότερη εργασία κατά τη διάρκεια της άσκησης. Οι προπονημένοι αθλητές αντοχής είχαν μεγαλύτερες βελτιώσεις σε μια χρονική δοκιμή τρεξίματος 12 λεπτών μετά από 3 εβδομάδες αερόβιας προπόνησης ενώ κατανάλωναν δίαιτα χαμηλού γλυκογόνου σε σύγκριση με μέτρια δίαιτα .
Μερικές μελέτες που συνέκριναν προπόνηση με υψηλό έναντι χαμηλού γλυκογόνου έχουν αναφέρει παρόμοιες βελτιώσεις στην απόδοση μεταξύ των ομάδων, ωστόσο μεγαλύτερες βελτιώσεις παρατηρήθηκαν μετά από μία και τρεις εβδομάδες προπόνησης δύο φορές την ημέρα με χαμηλό CHO έναντι υψηλής κατανάλωση CHO μεταξύ των συνεδριών και δύο φορές έναντι μιας ημερήσιας προπόνησης.
Δύο μελέτες που χρησιμοποίησαν έναν συνδυασμό τακτικών για να διαφοροποιήσουν τη διαθεσιμότητα CHO γύρω από προπονήσεις (δηλαδή, περιοδική-CHO) βρήκαν παρόμοιες βελτιώσεις μεταξύ της χρόνιας δίαιτας υψηλής CHO και της περιοδικής CHO, οι οποίες οδήγησαν σε μεγαλύτερες βελτιώσεις από μια χρόνια δίαιτα χαμηλού CHO.
Που καταλήγει η επιστήμη
Σε μια προσπάθεια να βελτιστοποιηθούν τόσο οι προσαρμογές της προπόνησης όσο και η οξεία απόδοση κατά τη διάρκεια βασικών προπονήσεων, οι τρέχουσες οδηγίες αθλητικής διατροφής προτείνουν η προπόνηση να εκτελείται τόσο με υψηλή διαθεσιμότητα CHO, προκειμένου να ενισχυθούν οι οδοί γλυκολυτικής και οξείδωσης CHO και χαμηλή διαθεσιμότητα CHO για την αύξηση της ενεργοποίησης της οξείας κυτταρικής σηματοδότησης που σχετίζονται με τη μιτοχονδριακή βιογένεση και την οξείδωση του λίπους.
Παρά το σκεπτικό για μια περιοδική προσέγγιση στη διατροφή, σύμφωνα με την οποία η διαθεσιμότητα CHO για κάθε προπόνηση ποικίλλει ανάλογα με τον τύπο της συνεδρίας και τους στόχους της σε έναν περιοδικό κύκλο προπόνησης , πολλοί αθλητές δεν ακολουθούν αυτές τις συστάσεις ήκαι δεν έχουν ξεκαθαρίσει τις γραμμές βέλτιστης πρακτικής. Για παράδειγμα, μόνο το 17–27% των ελίτ αθλητών αναφέρει ότι ακολουθεί μια περιοδική δίαιτα-CHO και λιγότεροι από τους μισούς αθλητές αντοχής αναφέρουν ότι διαφοροποιούν τις διατροφικές τους επιλογές πριν από την άσκηση με βάση τη διάρκεια ή την ένταση της άσκησης.
Αν και η προπόνηση σε κατάσταση ολονύκτιας νηστείας εκτελείται από σχεδόν τα δύο τρίτα των αθλητών αντοχής (63%), πολλοί το κάνουν επειδή πιστεύουν ότι είναι ωφέλιμο, ενώ άλλοι το αποφεύγουν επειδή πιστεύουν ότι δεν είναι ωφέλιμο . Επιπλέον, σχεδόν όλες οι πεποιθήσεις και οι πρακτικές που σχετίζονται με τη διατροφή πριν από την άσκηση φαίνεται να ποικίλλουν με βάση το φύλο, το ανταγωνιστικό επίπεδο και το συνηθισμένο διατροφικό πρότυπο. Συνολικά, αυτό υπογραμμίζει την ανάγκη για περισσότερη έρευνα σε εκπαιδευμένους αθλητές, καθώς και βελτιωμένη επικοινωνία της διαθέσιμης έρευνας σε αθλητές και προπονητές, οι οποίοι δείχνουν σε μεγάλο ποσοστό να αγνοούν έστω και τις βασικές αρχές για το θέμα.
Από την άποψη της πρακτικής εφαρμογής, η διάρκεια και η ένταση της συνεδρίας άσκησης θα πρέπει να λαμβάνονται υπόψη κατά την εξέταση των καλύτερων διατροφικών επιλογών πριν από την άσκηση, μαζί με τις προσωπικές προτιμήσεις κάθε αθλητή, όπως περιγράφεται στο παρακάτω γράφημα. Σε κάθε περίπτωση η σχετική επίδραση της διατροφής στις προσαρμογές της προπόνησης μπορεί να ποικίλλει ανάλογα με το φύλο, τον ΔΜΣ και την κατάσταση της προπόνησης.
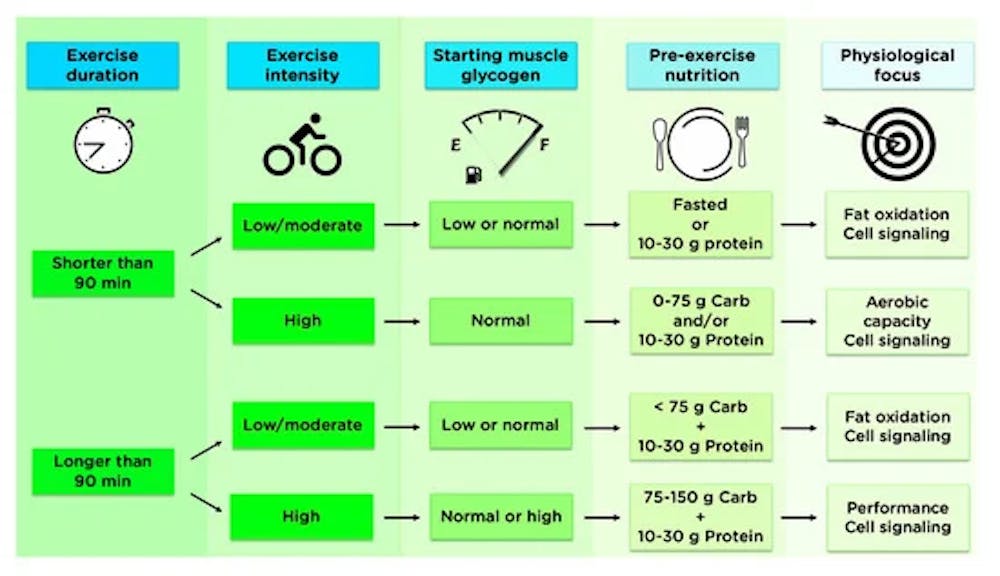
Πρακτική εφαρμογή της διατροφής πριν από την άσκηση για τη βελτιστοποίηση των προσαρμογών της προπόνησης. Η διάρκεια και η ένταση της συνεδρίας άσκησης πρέπει να λαμβάνονται υπόψη όταν εξετάζονται οι καλύτερες διατροφικές επιλογές πριν από την άσκηση. Πριν από συνεδρίες άσκησης μικρότερης διάρκειας που εστιάζουν στην προπόνηση σταθερής κατάστασης χαμηλότερης έντασης, μπορεί να είναι ωφέλιμο να διακοπεί η CHO(υδατάνθρακας), ενώ υπάρχουν λίγα στοιχεία που υποστηρίζουν τον περιορισμό της CHO πριν από την άσκηση υψηλής έντασης. Όταν καταναλώνετε λιγότερο από ~75 g CHO, οι επιλογές τροφίμων πριν από το HIIT μπορούν να αφεθούν στην προσωπική προτίμηση. Για άσκηση μεγαλύτερης διάρκειας (>90 λεπτά), υπάρχουν ελάχιστα στοιχεία που να υποδεικνύουν ότι η προπόνηση σε κατάσταση νηστείας προσφέρει κάποιο πρόσθετο όφελος, αν και αυτό εξακολουθεί να ασκείται από περίπου το ένα τρίτο των αθλητών αντοχής .Η κατάναλωση λιγότερο από ~ 75 g CHO είναι απίθανο να επηρεάσει τις προσαρμογές σηματοδότησης των μιτοχονδρίων από άσκηση μεγαλύτερης διάρκειας και χαμηλής έντασης, ενώ η κατανάλωση 75-150 g CHO πριν από παρατεταμένη άσκηση υψηλής έντασης προτείνεται για αύξηση της ενδογενούς αποθήκευσης καυσίμου.
Η πρακτική εφαρμογή
Η διαθεσιμότητα ενδογενούς και εξωγενούς CHO, λίπους και πρωτεΐνης πριν και κατά τη διάρκεια της άσκησης μπορεί να επηρεάσει τις οξείες και μακροπρόθεσμες αποκρίσεις στην άσκηση αντοχής. Η μεγάλη κατανάλωση CHO αναστέλλει την καύση λίπους, ωστόσο λείπουν στοιχεία που δείχνουν ενισχυμένη ικανότητα καύσης λίπους μετά από μακροχρόνια προπόνηση σε κατάσταση νηστείας. Τα αντίθετα ευρήματα που σχετίζονται με την επίδραση της λήψης CHO στη σηματοδότηση των μιτοχονδρίων μπορεί να σχετίζονται με την ποσότητα υδατανθράκων που καταναλώνεται και την ένταση της άσκησης. Η κατανάλωση >120 g CHO πριν από την υπομέγιστη, σταθερής κατάστασης άσκηση έχει αμβλύνει τη μιτοχονδριακή σηματοδότηση, ενώ <70 g CHO όχι, ωστόσο η διαθεσιμότητα CHO φαίνεται να έχει ελάχιστα αποτελέσματα μετά την άσκηση HIIT.
Η απόδοση βελτιώνεται μετά από κατάποση CHO πριν από την άσκηση για άσκηση μεγαλύτερης αλλά όχι μικρότερης διάρκειας, ενώ οι αλλαγές απόδοσης που προκαλούνται από την προπόνηση μετά από διάφορες διατροφικές στρατηγικές πριν από την άσκηση ποικίλουν ανάλογα με τον τύπο του διατροφικού πρωτοκόλλου που χρησιμοποιείται. Θα πρέπει να δίνεται προσοχή κατά τη γενίκευση αυτών των ευρημάτων σε ευρύτερους πληθυσμούς, καθώς η πλειονότητα των συμμετεχόντων στην μεταανάλυση των 165 μελετών ήταν εκπαιδευμένοι άνδρες ηλικίας μεταξύ 20-30 ετών.
Συμπληρωματικά Υλικά
Η λίστα των 165 μελετών
Seiler, S. What is best practice for training intensity and duration distribution in endurance athletes? Int. J. Sports Physiol. Perform. 2010, 5, 276–291. [Google Scholar] [CrossRef] [PubMed]
Earnest, C.P.; Rothschild, J.; Harnish, C.R.; Naderi, A. Metabolic adaptations to endurance training and nutrition strategies influencing performance. Res. Sports Med. 2019, 27, 134–146. [Google Scholar] [CrossRef] [PubMed]
Stellingwerff, T.; Morton, J.P.; Burke, L.M. A Framework for Periodized Nutrition for Athletics. Int. J. Sport Nutr. Exerc. Metab. 2019, 29, 141–151. [Google Scholar] [CrossRef] [PubMed][Green Version]
Tokmakidis, S.P.; Karamanolis, I.A. Effects of carbohydrate ingestion 15 min before exercise on endurance running capacity. Appl. Physiol. Nutr. Metab. 2008, 33, 441–449. [Google Scholar] [CrossRef]
Sherman, W.M.; Peden, M.C.; Wright, D.A. Carbohydrate feedings 1 h before exercise improves cycling performance. Am. J. Clin. Nutr. 1991, 54, 866–870. [Google Scholar] [CrossRef][Green Version]
Hawley, J.A.; Morton, J.P. Ramping up the signal: Promoting endurance training adaptation in skeletal muscle by nutritional manipulation. Clin. Exp. Pharmacol. Physiol. 2014, 41, 608–613. [Google Scholar] [CrossRef]
Philp, A.; Burke, L.M.; Baar, K. Altering endogenous carbohydrate availability to support training adaptations. Nestle Nutr. Inst. Workshop Ser. 2011, 69, 19–31. [Google Scholar] [CrossRef][Green Version]
Coffey, V.G.; Hawley, J.A. The molecular bases of training adaptation. Sports Med. 2007, 37, 737–763. [Google Scholar] [CrossRef]
Civitarese, A.E.; Hesselink, M.K.; Russell, A.P.; Ravussin, E.; Schrauwen, P. Glucose ingestion during exercise blunts exercise-induced gene expression of skeletal muscle fat oxidative genes. Am. J. Physiol. Endocrinol. Metab. 2005, 289, E1023–E1029. [Google Scholar] [CrossRef][Green Version]
Edinburgh, R.M.; Hengist, A.; Smith, H.A.; Travers, R.L.; Koumanov, F.; Betts, J.A.; Thompson, D.; Walhin, J.P.; Wallis, G.A.; Hamilton, D.L.; et al. Preexercise breakfast ingestion versus extended overnight fasting increases postprandial glucose flux after exercise in healthy men. Am. J. Physiol. Endocrinol. Metab. 2018, 315, E1062–E1074. [Google Scholar] [CrossRef][Green Version]
Lee-Young, R.S.; Palmer, M.J.; Linden, K.C.; LePlastrier, K.; Canny, B.J.; Hargreaves, M.; Wadley, G.D.; Kemp, B.E.; McConell, G.K. Carbohydrate ingestion does not alter skeletal muscle AMPK signaling during exercise in humans. Am. J. Physiol. Endocrinol. Metab. 2006, 291, E566–E573. [Google Scholar] [CrossRef] [PubMed][Green Version]
Van Proeyen, K.; Szlufcik, K.; Nielens, H.; Pelgrim, K.; Deldicque, L.; Hesselink, M.; Van Veldhoven, P.; Hespel, P. Training in the fasted state improves glucose tolerance during fat-rich diet. J. Physiol. 2010, 588, 4289–4302. [Google Scholar] [CrossRef] [PubMed]
Stannard, S.R.; Buckley, A.J.; Edge, J.A.; Thompson, M.W. Adaptations to skeletal muscle with endurance exercise training in the acutely fed versus overnight-fasted state. J. Sci. Med. Sport 2010, 13, 465–469. [Google Scholar] [CrossRef] [PubMed]
De Bock, K.; Derave, W.; Eijnde, B.O.; Hesselink, M.K.; Koninckx, E.; Rose, A.J.; Schrauwen, P.; Bonen, A.; Richter, E.A.; Hespel, P. Effect of training in the fasted state on metabolic responses during exercise with carbohydrate intake. J. Appl. Physiol. (1985) 2008, 104, 1045–1055. [Google Scholar] [CrossRef][Green Version]
Rothschild, J.A.; Kilding, A.E.; Plews, D.J. Prevalence and determinants of fasted training in endurance athletes: A survey analysis. Int. J. Sport Nutr. Exerc. Metab. 2020, 30, 345–356. [Google Scholar] [CrossRef]
Rothschild, J.; Kilding, A.E.; Plews, D.J. Pre-exercise nutrition habits and beliefs of endurance athletes vary by sex, competitive level and diet. J. Am. Coll. Nutr. 2020, in press. [Google Scholar] [CrossRef]
Wadley, G.D.; Nicolas, M.A.; Hiam, D.; McConell, G.K. Xanthine oxidase inhibition attenuates skeletal muscle signaling following acute exercise but does not impair mitochondrial adaptations to endurance training. Am. J. Physiol.-Endocrinol. Metab. 2013, 304, E853–E862. [Google Scholar] [CrossRef][Green Version]
Cochran, A.J.; Percival, M.E.; Tricarico, S.; Little, J.P.; Cermak, N.; Gillen, J.B.; Tarnopolsky, M.A.; Gibala, M.J. Intermittent and continuous high-intensity exercise training induce similar acute but different chronic muscle adaptations. Exp. Physiol. 2014, 99, 782–791. [Google Scholar] [CrossRef][Green Version]
Perry, C.G.; Lally, J.; Holloway, G.P.; Heigenhauser, G.J.; Bonen, A.; Spriet, L.L. Repeated transient mRNA bursts precede increases in transcriptional and mitochondrial proteins during training in human skeletal muscle. J. Physiol. 2010, 588, 4795–4810. [Google Scholar] [CrossRef]
Trefts, E.; Williams, A.S.; Wasserman, D.H. Exercise and the Regulation of Hepatic Metabolism. Prog. Mol. Biol. Transl. Sci. 2015, 135, 203–225. [Google Scholar] [CrossRef][Green Version]
Nilsson, L.H.; Hultman, E. Liver glycogen in man–-the effect of total starvation or a carbohydrate-poor diet followed by carbohydrate refeeding. Scand. J. Clin. Lab. Investig. 1973, 32, 325–330. [Google Scholar] [CrossRef] [PubMed]
Dohm, G.L.; Beeker, R.T.; Israel, R.G.; Tapscott, E.B. Metabolic responses to exercise after fasting. J. Appl. Physiol. 1986, 61, 1363–1368. [Google Scholar] [CrossRef] [PubMed]
Margolis, L.M.; Wilson, M.A.; Whitney, C.C.; Carrigan, C.T.; Murphy, N.E.; Hatch, A.M.; Montain, S.J.; Pasiakos, S.M. Exercising with low muscle glycogen content increases fat oxidation and decreases endogenous, but not exogenous carbohydrate oxidation. Metabolism 2019, 97, 1–8. [Google Scholar] [CrossRef] [PubMed]
Coggan, A.R.; Coyle, E.F. Carbohydrate ingestion during prolonged exercise: Effects on metabolism and performance. Exerc. Sport Sci. Rev. 1991, 19, 1–40. [Google Scholar] [CrossRef]
Vieira, A.F.; Costa, R.R.; Macedo, R.C.O.; Coconcelli, L.; Kruel, L.F.M. Effects of aerobic exercise performed in fasted v. fed state on fat and carbohydrate metabolism in adults: A systematic review and meta-analysis. Br. J. Nutr. 2016, 116, 1153–1164. [Google Scholar] [CrossRef][Green Version]
Andersson Hall, U.; Edin, F.; Pedersen, A.; Madsen, K. Whole-body fat oxidation increases more by prior exercise than overnight fasting in elite endurance athletes. Appl. Physiol. Nutr. Metab. 2015, 41, 430–437. [Google Scholar] [CrossRef] [PubMed][Green Version]
Marmy-Conus, N.; Fabris, S.; Proietto, J.; Hargreaves, M. Preexercise glucose ingestion and glucose kinetics during exercise. J. Appl. Physiol. 1996, 81, 853–857. [Google Scholar] [CrossRef]
Horowitz, J.F.; Mora-Rodriguez, R.; Byerley, L.O.; Coyle, E.F. Lipolytic suppression following carbohydrate ingestion limits fat oxidation during exercise. Am. J. Physiol. 1997, 273, E768–E775. [Google Scholar] [CrossRef] [PubMed]
Coyle, E.F.; Jeukendrup, A.E.; Wagenmakers, A.; Saris, W. Fatty acid oxidation is directly regulated by carbohydrate metabolism during exercise. Am. J. Physiol.-Endocrinol. Metab. 1997, 273, E268–E275. [Google Scholar] [CrossRef]
De Bock, K.; Richter, E.A.; Russell, A.; Eijnde, B.O.; Derave, W.; Ramaekers, M.; Koninckx, E.; Leger, B.; Verhaeghe, J.; Hespel, P. Exercise in the fasted state facilitates fibre type-specific intramyocellular lipid breakdown and stimulates glycogen resynthesis in humans. J. Physiol. 2005, 564, 649–660. [Google Scholar] [CrossRef]
Edinburgh, R.M.; Bradley, H.E.; Abdullah, N.-F.; Robinson, S.L.; Chrzanowski-Smith, O.J.; Walhin, J.-P.; Joanisse, S.; Manolopoulos, K.N.; Philp, A.; Hengist, A.; et al. Lipid metabolism links nutrient-exercise timing to insulin sensitivity in men classified as overweight or obese. J. Clin. Endocrinol. Metab. 2020, 105, 660–676. [Google Scholar] [CrossRef][Green Version]
Van Loon, L.J.; Koopman, R.; Stegen, J.H.; Wagenmakers, A.J.; Keizer, H.A.; Saris, W.H. Intramyocellular lipids form an important substrate source during moderate intensity exercise in endurance-trained males in a fasted state. J. Physiol. 2003, 553, 611–625. [Google Scholar] [CrossRef][Green Version]
Montain, S.J.; Hopper, M.; Coggan, A.R.; Coyle, E.F. Exercise metabolism at different time intervals after a meal. J. Appl. Physiol. 1991, 70, 882–888. [Google Scholar] [CrossRef] [PubMed]
Knapik, J.J.; Meredith, C.N.; Jones, B.H.; Suek, L.; Young, V.R.; Evans, W.J. Influence of fasting on carbohydrate and fat metabolism during rest and exercise in men. J. Appl. Physiol. (1985) 1988, 64, 1923–1929. [Google Scholar] [CrossRef] [PubMed]
Hansen, A.K.; Fischer, C.P.; Plomgaard, P.; Andersen, J.L.; Saltin, B.; Pedersen, B.K. Skeletal muscle adaptation: Training twice every second day vs. training once daily. J. Appl. Physiol. 2005, 98, 93–99. [Google Scholar] [CrossRef] [PubMed][Green Version]
Bartlett, J.D.; Louhelainen, J.; Iqbal, Z.; Cochran, A.J.; Gibala, M.J.; Gregson, W.; Close, G.L.; Drust, B.; Morton, J.P. Reduced carbohydrate availability enhances exercise-induced p53 signaling in human skeletal muscle: Implications for mitochondrial biogenesis. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2013, 304, R450–R458. [Google Scholar] [CrossRef] [PubMed][Green Version]
Gillen, J.B.; West, D.W.D.; Williamson, E.P.; Fung, H.J.W.; Moore, D.R. Low-Carbohydrate Training Increases Protein Requirements of Endurance Athletes. Med. Sci. Sports Exerc. 2019, 51, 2294–2301. [Google Scholar] [CrossRef]
Howarth, K.R.; Phillips, S.M.; MacDonald, M.J.; Richards, D.; Moreau, N.A.; Gibala, M.J. Effect of glycogen availability on human skeletal muscle protein turnover during exercise and recovery. J. Appl. Physiol. (1985) 2010, 109, 431–438. [Google Scholar] [CrossRef][Green Version]
Lemon, P.W.; Mullin, J.P. Effect of initial muscle glycogen levels on protein catabolism during exercise. J. Appl. Physiol. Respir. Environ. Exerc. Physiol. 1980, 48, 624–629. [Google Scholar] [CrossRef]
Weltan, S.M.; Bosch, A.N.; Dennis, S.C.; Noakes, T.D. Preexercise muscle glycogen content affects metabolism during exercise despite maintenance of hyperglycemia. Am. J. Physiol. 1998, 274, E83–E88. [Google Scholar] [CrossRef]
Hargreaves, M.; McConell, G.; Proietto, J. Influence of muscle glycogen on glycogenolysis and glucose uptake during exercise in humans. J. Appl. Physiol. 1995, 78, 288–292. [Google Scholar] [CrossRef] [PubMed]
Devlin, J.T.; Calles-Escandon, J.; Horton, E.S. Effects of preexercise snack feeding on endurance cycle exercise. J. Appl. Physiol. 1986, 60, 980–985. [Google Scholar] [CrossRef] [PubMed]
Neufer, P.D.; Costill, D.L.; Flynn, M.G.; Kirwan, J.P.; Mitchell, J.B.; Houmard, J. Improvements in exercise performance: Effects of carbohydrate feedings and diet. J. Appl. Physiol. 1987, 62, 983–988. [Google Scholar] [CrossRef] [PubMed]
Febbraio, M.A.; Stewart, K.L. CHO feeding before prolonged exercise: Effect of glycemic index on muscle glycogenolysis and exercise performance. J. Appl. Physiol. 1996, 81, 1115–1120. [Google Scholar] [CrossRef] [PubMed]
Tsintzas, K.; Williams, C. Human muscle glycogen metabolism during exercise. Effect of carbohydrate supplementation. Sports Med. 1998, 25, 7–23. [Google Scholar] [CrossRef] [PubMed]
Impey, S.G.; Smith, D.; Robinson, A.L.; Owens, D.J.; Bartlett, J.D.; Smith, K.; Limb, M.; Tang, J.; Fraser, W.D.; Close, G.L. Leucine-enriched protein feeding does not impair exercise-induced free fatty acid availability and lipid oxidation: Beneficial implications for training in carbohydrate-restricted states. Amino Acids 2015, 47, 407–416. [Google Scholar] [CrossRef]
Taylor, C.; Bartlett, J.D.; van de Graaf, C.S.; Louhelainen, J.; Coyne, V.; Iqbal, Z.; MacLaren, D.P.; Gregson, W.; Close, G.L.; Morton, J.P. Protein ingestion does not impair exercise-induced AMPK signalling when in a glycogen-depleted state: Implications for train-low compete-high. Eur. J. Appl. Physiol. 2013, 113, 1457–1468. [Google Scholar] [CrossRef]
Enevoldsen, L.; Simonsen, L.; Macdonald, I.; Bülow, J. The combined effects of exercise and food intake on adipose tissue and splanchnic metabolism. J. Physiol. 2004, 561, 871–882. [Google Scholar] [CrossRef]
Larsen, M.S.; Holm, L.; Svart, M.V.; Hjelholt, A.J.; Bengtsen, M.B.; Dollerup, O.L.; Dalgaard, L.B.; Vendelbo, M.H.; van Hall, G.; Moller, N.; et al. Effects of protein intake prior to carbohydrate-restricted endurance exercise: A randomized crossover trial. J. Int. Soc. Sports Nutr. 2020, 17, 7. [Google Scholar] [CrossRef][Green Version]
Wright, D.; Sherman, W.; Dernbach, A. Carbohydrate feedings before, during, or in combination improve cycling endurance performance. J. Appl. Physiol. 1991, 71, 1082–1088. [Google Scholar] [CrossRef]
Romijn, J.A.; Coyle, E.F.; Sidossis, L.S.; Gastaldelli, A.; Horowitz, J.F.; Endert, E.; Wolfe, R.R. Regulation of endogenous fat and carbohydrate metabolism in relation to exercise intensity and duration. Am. J. Physiol. 1993, 265, E380–E391. [Google Scholar] [CrossRef][Green Version]
Sherman, W.M.; Brodowicz, G.; Wright, D.A.; Allen, W.K.; Simonsen, J.; Dernbach, A. Effects of 4 h preexercise carbohydrate feedings on cycling performance. Med. Sci. Sports Exerc. 1989, 21, 598–604. [Google Scholar] [CrossRef] [PubMed]
Jentjens, R.L.; Cale, C.; Gutch, C.; Jeukendrup, A.E. Effects of pre-exercise ingestion of differing amounts of carbohydrate on subsequent metabolism and cycling performance. Eur. J. Appl. Physiol. 2003, 88, 444–452. [Google Scholar] [CrossRef] [PubMed]
Calles-Escandón, J.; Devlin, J.T.; Whitcomb, W.; Horton, E.S. Pre-exercise feeding does not affect endurance cycle exercise but attenuates post-exercise starvation-like response. Med. Sci. Sports Exerc. 1991, 23, 818–824. [Google Scholar] [PubMed]
Cramp, T.; Broad, E.; Martin, D.; Meyer, B.J. Effects of preexercise carbohydrate ingestion on mountain bike performance. Med. Sci. Sports Exerc. 2004, 36, 1602–1609. [Google Scholar] [CrossRef] [PubMed]
Khong, T.K.; Selvanayagam, V.S.; Hamzah, S.H.; Yusof, A. Effect of quantity and quality of pre-exercise carbohydrate meals on central fatigue. J. Appl. Physiol. 2018, 125, 1021–1029. [Google Scholar] [CrossRef]
Okano, G.; Sato, Y.; Takumi, Y.; Sugawara, M. Effect of 4h preexercise high carbohydrate and high fat meal ingestion on endurance performance and metabolism. Int. J. Sports Med. 1996, 17, 530–534. [Google Scholar] [CrossRef]
Smith, G.J.; Rhodes, E.C.; Langill, R.H. The effect of pre-exercise glucose ingestion on performance during prolonged swimming. Int. J. Sport Nutr. Exerc. Metab. 2002, 12, 136–144. [Google Scholar] [CrossRef]
Coyle, E.F.; Coggan, A.R.; Hemmert, M.K.; Lowe, R.C.; Walters, T.J. Substrate usage during prolonged exercise following a preexercise meal. J. Appl. Physiol. 1985, 59, 429–433. [Google Scholar] [CrossRef]
Whitley, H.A.; Humphreys, S.M.; Campbell, I.T.; Keegan, M.A.; Jayanetti, T.D.; Sperry, D.A.; MacLaren, D.P.; Reilly, T.; Frayn, K.N. Metabolic and performance responses during endurance exercise after high-fat and high-carbohydrate meals. J. Appl. Physiol. 1998, 85, 418–424. [Google Scholar] [CrossRef][Green Version]
Moseley, L.; Lancaster, G.I.; Jeukendrup, A.E. Effects of timing of pre-exercise ingestion of carbohydrate on subsequent metabolism and cycling performance. Eur. J. Appl. Physiol. 2003, 88, 453–458. [Google Scholar] [CrossRef] [PubMed]
Willcutts, K.F.; Wilcox, A.; Grunewald, K. Energy metabolism during exercise at different time intervals following a meal. Int. J. Sports Med. 1988, 9, 240–243. [Google Scholar] [CrossRef] [PubMed][Green Version]
Wismann, J.; Willoughby, D. Gender differences in carbohydrate metabolism and carbohydrate loading. J. Int. Soc. Sports Nutr. 2006, 3, 28–34. [Google Scholar] [CrossRef] [PubMed][Green Version]
Ashley, C.D.; Kramer, M.L.; Bishop, P. Estrogen and substrate metabolism: A review of contradictory research. Sports Med. 2000, 29, 221–227. [Google Scholar] [CrossRef]
Sims, S.T.; Heather, A.K. Myths and Methodologies: Reducing scientific design ambiguity in studies comparing sexes and/or menstrual cycle phases. Exp. Physiol. 2018, 103, 1309–1317. [Google Scholar] [CrossRef][Green Version]
Aird, T.P.; Davies, R.W.; Carson, B.P. Effects of fasted vs. fed state exercise on performance and post-exercise metabolism: A systematic review & meta-analysis. Scand. J. Med. Sci. Sports 2018, 28, 1476–1493. [Google Scholar]
Galloway, S.D.; Lott, M.J.; Toulouse, L.C. Preexercise carbohydrate feeding and high-intensity exercise capacity: Effects of timing of intake and carbohydrate concentration. Int. J. Sport Nutr. Exerc. Metab. 2014, 24, 258–266. [Google Scholar] [CrossRef][Green Version]
Little, J.P.; Chilibeck, P.D.; Ciona, D.; Forbes, S.; Rees, H.; Vandenberg, A.; Zello, G.A. Effect of low- and high-glycemic-index meals on metabolism and performance during high-intensity, intermittent exercise. Int. J. Sport Nutr. Exerc. Metab. 2010, 20, 447–456. [Google Scholar] [CrossRef][Green Version]
Scott, J.P.; Sale, C.; Greeves, J.P.; Casey, A.; Dutton, J.; Fraser, W.D. Effect of fasting versus feeding on the bone metabolic response to running. Bone 2012, 51, 990–999. [Google Scholar] [CrossRef]
Hetlelid, K.J.; Plews, D.J.; Herold, E.; Laursen, P.B.; Seiler, S. Rethinking the role of fat oxidation: Substrate utilisation during high-intensity interval training in well-trained and recreationally trained runners. BMJ Open Sport Exerc. Med. 2015, 1, e000047. [Google Scholar] [CrossRef][Green Version]
Tenforde, A.S.; Barrack, M.T.; Nattiv, A.; Fredericson, M. Parallels with the Female Athlete Triad in Male Athletes. Sports Med. 2016, 46, 171–182. [Google Scholar] [CrossRef] [PubMed]
Wilson, P.B. ‘I think I’m gonna hurl’: A Narrative Review of the Causes of Nausea and Vomiting in Sport. Sports 2019, 7, 162. [Google Scholar] [CrossRef] [PubMed][Green Version]
De Oliveira, E.P.; Burini, R.C.; Jeukendrup, A. Gastrointestinal complaints during exercise: Prevalence, etiology, and nutritional recommendations. Sports Med. 2014, 44 (Suppl. 1), S79–S85. [Google Scholar] [CrossRef] [PubMed][Green Version]
Egan, B.; Zierath, J.R. Exercise metabolism and the molecular regulation of skeletal muscle adaptation. Cell Metab. 2013, 17, 162–184. [Google Scholar] [CrossRef] [PubMed][Green Version]
Hardie, D.G.; Ross, F.A.; Hawley, S.A. AMPK: A nutrient and energy sensor that maintains energy homeostasis. Nat. Rev. Mol. Cell Biol. 2012, 13, 251–262. [Google Scholar] [CrossRef] [PubMed][Green Version]
Steinberg, G.R.; Kemp, B.E. AMPK in Health and Disease. Physiol. Rev. 2009, 89, 1025–1078. [Google Scholar] [CrossRef]
Wojtaszewski, J.F.; Nielsen, P.; Hansen, B.F.; Richter, E.A.; Kiens, B. Isoform-specific and exercise intensity-dependent activation of 5′-AMP-activated protein kinase in human skeletal muscle. J. Physiol. 2000, 528, 221–226. [Google Scholar] [CrossRef]
McConell, G.K.; Wadley, G.D.; Le Plastrier, K.; Linden, K.C. Skeletal muscle AMPK is not activated during 2 h of moderate intensity exercise at∼ 65% VO2 peak in endurance trained men. J. Physiol. 2020, 598, 3859–3870. [Google Scholar] [CrossRef]
Janzen, N.R.; Whitfield, J.; Hoffman, N.J. Interactive Roles for AMPK and Glycogen from Cellular Energy Sensing to Exercise Metabolism. Int. J. Mol. Sci. 2018, 19, 3344. [Google Scholar] [CrossRef][Green Version]
Bartlett, J.D.; Hawley, J.A.; Morton, J.P. Carbohydrate availability and exercise training adaptation: Too much of a good thing? Eur. J. Sport Sci. 2015, 15, 3–12. [Google Scholar] [CrossRef]
Akerstrom, T.C.; Birk, J.B.; Klein, D.K.; Erikstrup, C.; Plomgaard, P.; Pedersen, B.K.; Wojtaszewski, J. Oral glucose ingestion attenuates exercise-induced activation of 5′-AMP-activated protein kinase in human skeletal muscle. Biochem. Biophys. Res. Commun. 2006, 342, 949–955. [Google Scholar] [CrossRef]
Treebak, J.T.; Pehmoller, C.; Kristensen, J.M.; Kjobsted, R.; Birk, J.B.; Schjerling, P.; Richter, E.A.; Goodyear, L.J.; Wojtaszewski, J.F. Acute exercise and physiological insulin induce distinct phosphorylation signatures on TBC1D1 and TBC1D4 proteins in human skeletal muscle. J. Physiol. 2014, 592, 351–375. [Google Scholar] [CrossRef]
Roepstorff, C.; Halberg, N.; Hillig, T.; Saha, A.K.; Ruderman, N.B.; Wojtaszewski, J.F.; Richter, E.A.; Kiens, B. Malonyl-CoA and carnitine in regulation of fat oxidation in human skeletal muscle during exercise. Am. J. Physiol. Endocrinol. Metab. 2005, 288, E133–E142. [Google Scholar] [CrossRef][Green Version]
Steinberg, G.R.; Watt, M.J.; McGee, S.L.; Chan, S.; Hargreaves, M.; Febbraio, M.A.; Stapleton, D.; Kemp, B.E. Reduced glycogen availability is associated with increased AMPKα2 activity, nuclear AMPKα2 protein abundance, and GLUT4 mRNA expression in contracting human skeletal muscle. Appl. Physiol. Nutr. Metab. 2006, 31, 302–312. [Google Scholar] [CrossRef][Green Version]
Wojtaszewski, J.F.; MacDonald, C.; Nielsen, J.N.; Hellsten, Y.; Hardie, D.G.; Kemp, B.E.; Kiens, B.; Richter, E.A. Regulation of 5′ AMP-activated protein kinase activity and substrate utilization in exercising human skeletal muscle. Am. J. Physiol. Endocrinol. Metab. 2003, 284, E813–E822. [Google Scholar] [CrossRef][Green Version]
Impey, S.G.; Hammond, K.M.; Shepherd, S.O.; Sharples, A.P.; Stewart, C.; Limb, M.; Smith, K.; Philp, A.; Jeromson, S.; Hamilton, D.L.; et al. Fuel for the work required: A practical approach to amalgamating train-low paradigms for endurance athletes. Physiol. Rep. 2016, 4. [Google Scholar] [CrossRef]
Hearris, M.A.; Hammond, K.M.; Seaborne, R.A.; Stocks, B.; Shepherd, S.O.; Philp, A.; Sharples, A.P.; Morton, J.P.; Louis, J.B. Graded reductions in preexercise muscle glycogen impair exercise capacity but do not augment skeletal muscle cell signaling: Implications for CHO periodization. J. Appl. Physiol. 2019, 126, 1587–1597. [Google Scholar] [CrossRef]
Hearris, M.A.; Owens, D.J.; Strauss, J.A.; Shepherd, S.O.; Sharples, A.P.; Morton, J.P.; Louis, J.B. Graded reductions in pre-exercise glycogen concentration do not augment exercise-induced nuclear AMPK and PGC-1α protein content in human muscle. Exp. Physiol. 2020. in Press. [Google Scholar] [CrossRef]
Stocks, B.; Dent, J.R.; Ogden, H.B.; Zemp, M.; Philp, A. Postexercise skeletal muscle signaling responses to moderate- to high-intensity steady-state exercise in the fed or fasted state. Am. J. Physiol. Endocrinol. Metab. 2019, 316, E230–E238. [Google Scholar] [CrossRef]
McConell, G.K.; Lee-Young, R.S.; Chen, Z.P.; Stepto, N.K.; Huynh, N.N.; Stephens, T.J.; Canny, B.J.; Kemp, B.E. Short-term exercise training in humans reduces AMPK signalling during prolonged exercise independent of muscle glycogen. J. Physiol. 2005, 568, 665–676. [Google Scholar] [CrossRef]
Mortensen, B.; Hingst, J.R.; Frederiksen, N.; Hansen, R.W.; Christiansen, C.S.; Iversen, N.; Friedrichsen, M.; Birk, J.B.; Pilegaard, H.; Hellsten, Y.; et al. Effect of birth weight and 12 weeks of exercise training on exercise-induced AMPK signaling in human skeletal muscle. Am. J. Physiol. Endocrinol. Metab. 2013, 304, E1379–E1390. [Google Scholar] [CrossRef] [PubMed][Green Version]
Guerra, B.; Guadalupe-Grau, A.; Fuentes, T.; Ponce-Gonzalez, J.G.; Morales-Alamo, D.; Olmedillas, H.; Guillen-Salgado, J.; Santana, A.; Calbet, J.A. SIRT1, AMP-activated protein kinase phosphorylation and downstream kinases in response to a single bout of sprint exercise: Influence of glucose ingestion. Eur. J. Appl. Physiol. 2010, 109, 731–743. [Google Scholar] [CrossRef] [PubMed]
Morton, J.P.; Croft, L.; Bartlett, J.D.; MacLaren, D.P.; Reilly, T.; Evans, L.; McArdle, A.; Drust, B. Reduced carbohydrate availability does not modulate training-induced heat shock protein adaptations but does upregulate oxidative enzyme activity in human skeletal muscle. J. Appl. Physiol. 2009, 106, 1513–1521. [Google Scholar] [CrossRef] [PubMed][Green Version]
Akerstrom, T.C.; Fischer, C.P.; Plomgaard, P.; Thomsen, C.; Van Hall, G.; Pedersen, B.K. Glucose ingestion during endurance training does not alter adaptation. J. Appl. Physiol. 2009, 106, 1771–1779. [Google Scholar] [CrossRef]
Islam, H.; Edgett, B.A.; Bonafiglia, J.T.; Shulman, T.; Ma, A.; Quadrilatero, J.; Simpson, C.A.; Gurd, B.J. Repeatability of exercise-induced changes in mRNA expression and technical considerations for qPCR analysis in human skeletal muscle. Exp. Physiol. 2019, 104, 407–420. [Google Scholar] [CrossRef]
Chin, E.R. The role of calcium and calcium/calmodulin-dependent kinases in skeletal muscle plasticity and mitochondrial biogenesis. Proc. Nutr. Soc. 2004, 63, 279–286. [Google Scholar] [CrossRef][Green Version]
Wright, D.C. Mechanisms of calcium-induced mitochondrial biogenesis and GLUT4 synthesis. Appl. Physiol. Nutr. Metab. 2007, 32, 840–845. [Google Scholar] [CrossRef]
Margolis, L.M.; Pasiakos, S.M. Optimizing intramuscular adaptations to aerobic exercise: Effects of carbohydrate restriction and protein supplementation on mitochondrial biogenesis. Adv. Nutr. 2013, 4, 657–664. [Google Scholar] [CrossRef][Green Version]
Jordy, A.B.; Kiens, B. Regulation of exercise-induced lipid metabolism in skeletal muscle. Exp. Physiol. 2014, 99, 1586–1592. [Google Scholar] [CrossRef][Green Version]
Yeo, W.K.; McGee, S.L.; Carey, A.L.; Paton, C.D.; Garnham, A.P.; Hargreaves, M.; Hawley, J.A. Acute signalling responses to intense endurance training commenced with low or normal muscle glycogen. Exp. Physiol. 2010, 95, 351–358. [Google Scholar] [CrossRef]
Cochran, A.J.; Little, J.P.; Tarnopolsky, M.A.; Gibala, M.J. Carbohydrate feeding during recovery alters the skeletal muscle metabolic response to repeated sessions of high-intensity interval exercise in humans. J. Appl. Physiol. 2010, 108, 628–636. [Google Scholar] [CrossRef] [PubMed][Green Version]
Chan, M.S.; McGee, S.L.; Watt, M.J.; Hargreaves, M.; Febbraio, M.A. Altering dietary nutrient intake that reduces glycogen content leads to phosphorylation of nuclear p38 MAP kinase in human skeletal muscle: Association with IL-6 gene transcription during contraction. FASEB J. 2004, 18, 1785–1787. [Google Scholar] [CrossRef] [PubMed]
Zbinden-Foncea, H.; Van Loon, L.J.; Raymackers, J.-M.; Francaux, M.; Deldicque, L. Contribution of nonesterified fatty acids to mitogen-activated protein kinase activation in human skeletal muscle during endurance exercise. Int. J. Sport Nutr. Exerc. Metab. 2013, 23, 201–209. [Google Scholar] [CrossRef] [PubMed]
Garcia-Roves, P.; Huss, J.M.; Han, D.H.; Hancock, C.R.; Iglesias-Gutierrez, E.; Chen, M.; Holloszy, J.O. Raising plasma fatty acid concentration induces increased biogenesis of mitochondria in skeletal muscle. Proc. Natl. Acad. Sci. USA 2007, 104, 10709–10713. [Google Scholar] [CrossRef][Green Version]
Fritzen, A.M.; Lundsgaard, A.M.; Kiens, B. Tuning fatty acid oxidation in skeletal muscle with dietary fat and exercise. Nat. Rev. Endocrinol. 2020, 16, 683–696. [Google Scholar] [CrossRef]
Gleeson, M.; Maughan, R.J.; Greenhaff, P.L. Comparison of the effects of pre-exercise feeding of glucose, glycerol and placebo on endurance and fuel homeostasis in man. Eur. J. Appl. Physiol. Occup. Physiol. 1986, 55, 645–653. [Google Scholar] [CrossRef]
Foster, C.; Costill, D.; Fink, W. Effects of preexercise feedings on endurance performance. Med. Sci. Sports 1979, 11, 1–5. [Google Scholar]
Febbraio, M.A.; Chiu, A.; Angus, D.J.; Arkinstall, M.J.; Hawley, J.A. Effects of carbohydrate ingestion before and during exercise on glucose kinetics and performance. J. Appl. Physiol. 2000, 89, 2220–2226. [Google Scholar] [CrossRef][Green Version]
Paul, D.; Jacobs, K.A.; Geor, R.J.; Hinchcliff, K.W. No effect of pre-exercise meal on substrate metabolism and time trial performance during intense endurance exercise. Int. J. Sport Nutr. Exerc. Metab. 2003, 13, 489–503. [Google Scholar] [CrossRef]
Margaritelis, N.V.; Paschalis, V.; Theodorou, A.A.; Kyparos, A.; Nikolaidis, M.G. Redox basis of exercise physiology. Redox Biol. 2020, 35, 101499. [Google Scholar] [CrossRef]
Gregersen, S.; Samocha-Bonet, D.; Heilbronn, L.K.; Campbell, L.V. Inflammatory and oxidative stress responses to high-carbohydrate and high-fat meals in healthy humans. J. Nutr. Metab. 2012, 2012, 238056. [Google Scholar] [CrossRef]
Margaritelis, N.V.; Theodorou, A.A.; Paschalis, V.; Veskoukis, A.S.; Dipla, K.; Zafeiridis, A.; Panayiotou, G.; Vrabas, I.S.; Kyparos, A.; Nikolaidis, M.G. Adaptations to endurance training depend on exercise-induced oxidative stress: Exploiting redox interindividual variability. Acta Physiol. 2018, 222, e12898. [Google Scholar] [CrossRef] [PubMed]
Henriquez-Olguin, C.; Renani, L.B.; Arab-Ceschia, L.; Raun, S.H.; Bhatia, A.; Li, Z.; Knudsen, J.R.; Holmdahl, R.; Jensen, T.E. Adaptations to high-intensity interval training in skeletal muscle require NADPH oxidase 2. Redox Biol. 2019, 24, 101188. [Google Scholar] [CrossRef] [PubMed]
Carnevale, R.; Pignatelli, P.; Nocella, C.; Loffredo, L.; Pastori, D.; Vicario, T.; Petruccioli, A.; Bartimoccia, S.; Violi, F. Extra virgin olive oil blunt post-prandial oxidative stress via NOX2 down-regulation. Atherosclerosis 2014, 235, 649–658. [Google Scholar] [CrossRef] [PubMed]
Nieman, D.C.; Gillitt, N.D.; Chen, G.-Y.; Zhang, Q.; Sha, W.; Kay, C.D.; Chandra, P.; Kay, K.L.; Lila, M.A. Blueberry and/or Banana Consumption Mitigate Arachidonic, Cytochrome P450 Oxylipin Generation During Recovery From 75-Km Cycling: A Randomized Trial. Front. Nutr. 2020, 7, 121. [Google Scholar] [CrossRef] [PubMed]
Chen, X.; Jia, G.; Liu, G.; Zhao, H.; Huang, Z. Effects of apple polyphenols on myofiber-type transformation in longissimus dorsi muscle of finishing pigs. Anim. Biotechnol. 2020, 1–8. [Google Scholar] [CrossRef] [PubMed]
Draganidis, D.; Karagounis, L.G.; Athanailidis, I.; Chatzinikolaou, A.; Jamurtas, A.Z.; Fatouros, I.G. Inflammaging and skeletal muscle: Can protein intake make a difference? J. Nutr. 2016, 146, 1940–1952. [Google Scholar] [CrossRef]
Cluberton, L.J.; McGee, S.L.; Murphy, R.M.; Hargreaves, M. Effect of carbohydrate ingestion on exercise-induced alterations in metabolic gene expression. J. Appl. Physiol. 2005, 99, 1359–1363. [Google Scholar] [CrossRef][Green Version]
Akerstrom, T.C.; Krogh-Madsen, R.; Petersen, A.M.; Pedersen, B.K. Glucose ingestion during endurance training in men attenuates expression of myokine receptor. Exp. Physiol. 2009, 94, 1124–1131. [Google Scholar] [CrossRef]
Spencer, M.K.; Yan, Z.; Katz, A. Carbohydrate supplementation attenuates IMP accumulation in human muscle during prolonged exercise. Am. J. Physiol. 1991, 261, C71–C76. [Google Scholar] [CrossRef]
Laursen, P.B. Training for intense exercise performance: High-intensity or high-volume training? Scand. J. Med. Sci. Sports 2010, 20 (Suppl. 2), 1–10. [Google Scholar] [CrossRef] [PubMed]
Combes, A.; Dekerle, J.; Webborn, N.; Watt, P.; Bougault, V.; Daussin, F.N. Exercise-induced metabolic fluctuations influence AMPK, p38-MAPK and CaMKII phosphorylation in human skeletal muscle. Physiol. Rep. 2015, 3, e12462. [Google Scholar] [CrossRef] [PubMed]
Chryssanthopoulos, C.; Williams, C.; Wilson, W.; Asher, L.; Hearne, L. Comparison between carbohydrate feedings before and during exercise on running performance during a 30-km treadmill time trial. Int. J. Sport Nutr. Exerc. Metab. 1994, 4, 374–386. [Google Scholar] [CrossRef] [PubMed][Green Version]
Burke, L.M.; Claassen, A.; Hawley, J.A.; Noakes, T.D. Carbohydrate intake during prolonged cycling minimizes effect of glycemic index of preexercise meal. J. Appl. Physiol. 1998, 85, 2220–2226. [Google Scholar] [CrossRef] [PubMed]
Rowlands, D.S.; Hopkins, W.G. Effect of high-fat, high-carbohydrate, and high-protein meals on metabolism and performance during endurance cycling. Int. J. Sport Nutr. Exerc. Metab. 2002, 12, 318–335. [Google Scholar] [CrossRef]
Learsi, S.K.; Ghiarone, T.; Silva-Cavalcante, M.D.; Andrade-Souza, V.A.; Ataide-Silva, T.; Bertuzzi, R.; de Araujo, G.G.; McConell, G.; Lima-Silva, A.E. Cycling time trial performance is improved by carbohydrate ingestion during exercise regardless of a fed or fasted state. Scand. J. Med. Sci. Sports 2019, 29, 651–662. [Google Scholar] [CrossRef]
Little, J.P.; Chilibeck, P.D.; Ciona, D.; Vandenberg, A.; Zello, G.A. The effects of low- and high-glycemic index foods on high-intensity intermittent exercise. Int. J. Sports Physiol. Perform. 2009, 4, 367–380. [Google Scholar] [CrossRef][Green Version]
Coffey, V.G.; Moore, D.R.; Burd, N.A.; Rerecich, T.; Stellingwerff, T.; Garnham, A.P.; Phillips, S.M.; Hawley, J.A. Nutrient provision increases signalling and protein synthesis in human skeletal muscle after repeated sprints. Eur. J. Appl. Physiol. 2011, 111, 1473–1483. [Google Scholar] [CrossRef]
Pritchett, K.; Bishop, P.; Pritchett, R.; Kovacs, M.; Davis, J.; Casaru, C.; Green, M. Effects of timing of pre-exercise nutrient intake on glucose responses and intermittent cycling performance. S. Afr. J. Sports Med. 2008, 20, 86–90. [Google Scholar] [CrossRef]
Astorino, T.A.; Sherrick, S.; Mariscal, M.; Jimenez, V.C.; Stetson, K.; Courtney, D. No effect of meal intake on physiological or perceptual responses to self-selected high intensity interval exercise (HIIE). Biol. Sport 2019, 36, 225. [Google Scholar] [CrossRef]
Murakami, I.; Sakuragi, T.; Uemura, H.; Menda, H.; Shindo, M.; Tanaka, H. Significant effect of a pre-exercise high-fat meal after a 3-day high-carbohydrate diet on endurance performance. Nutrients 2012, 4, 625–637. [Google Scholar] [CrossRef] [PubMed][Green Version]
Burdon, C.A.; Spronk, I.; Cheng, H.L.; O’Connor, H.T. Effect of Glycemic Index of a Pre-exercise Meal on Endurance Exercise Performance: A Systematic Review and Meta-analysis. Sports Med. 2017, 47, 1087–1101. [Google Scholar] [CrossRef] [PubMed]
Kern, M.; Heslin, C.J.; Rezende, R.S. Metabolic and performance effects of raisins versus sports gel as pre-exercise feedings in cyclists. J. Strength Cond. Res. 2007, 21, 1204–1207. [Google Scholar] [PubMed]
Campbell, C.; Prince, D.; Braun, M.; Applegate, E.; Casazza, G.A. Carbohydrate-supplement form and exercise performance. Int. J. Sport Nutr. Exerc. Metab. 2008, 18, 179–190. [Google Scholar] [CrossRef] [PubMed]
Cramer, M.J.; Dumke, C.L.; Hailes, W.S.; Cuddy, J.S.; Ruby, B.C. Postexercise Glycogen Recovery and Exercise Performance is Not Significantly Different Between Fast Food and Sport Supplements. Int. J. Sport Nutr. Exerc. Metab. 2015, 25, 448–455. [Google Scholar] [CrossRef]
Jeukendrup, A.E.; Killer, S.C. The myths surrounding pre-exercise carbohydrate feeding. Ann. Nutr. Metab. 2010, 57 (Suppl. 2), 18–25. [Google Scholar] [CrossRef]
Mears, S.A.; Dickinson, K.; Bergin-Taylor, K.; Dee, R.; Kay, J.; James, L.J. Perception of Breakfast Ingestion Enhances High-Intensity Cycling Performance. Int. J. Sports Physiol. Perform. 2018, 13, 504–509. [Google Scholar] [CrossRef][Green Version]
Clark, V.R.; Hopkins, W.G.; Hawley, J.A.; Burke, L.M. Placebo effect of carbohydrate feedings during a 40-km cycling time trial. Med. Sci. Sports Exerc. 2000, 32, 1642–1647. [Google Scholar] [CrossRef]
Hulston, C.J.; Jeukendrup, A.E. No placebo effect from carbohydrate intake during prolonged exercise. Int. J. Sport Nutr. Exerc. Metab. 2009, 19, 275–284. [Google Scholar] [CrossRef]
Waterworth, S.P.; Spencer, C.C.; Porter, A.L.; Morton, J.P. Perception of Carbohydrate Availability Augments High-Intensity Intermittent Exercise Capacity Under Sleep-Low, Train-Low Conditions. Int. J. Sport Nutr. Exerc. Metab. 2020, 30, 105–111. [Google Scholar] [CrossRef]
Riis, S.; Moller, A.B.; Dollerup, O.; Hoffner, L.; Jessen, N.; Madsen, K. Acute and sustained effects of a periodized carbohydrate intake using the sleep-low model in endurance-trained males. Scand. J. Med. Sci. Sports 2019, 29, 1866–1880. [Google Scholar] [CrossRef] [PubMed]
Marquet, L.-A.; Brisswalter, J.; Louis, J.; Tiollier, E.; Burke, L.; Hawley, J.; Hausswirth, C. Enhanced Endurance Performance by Periodization of CHO Intake:” sleep low” strategy. Med. Sci. Sports Exerc. 2016, 48, 663–672. [Google Scholar] [CrossRef] [PubMed]
Gillen, J.B.; Percival, M.E.; Ludzki, A.; Tarnopolsky, M.A.; Gibala, M. Interval training in the fed or fasted state improves body composition and muscle oxidative capacity in overweight women. Obesity 2013, 21, 2249–2255. [Google Scholar] [CrossRef] [PubMed]
Terada, T.; Toghi Eshghi, S.R.; Liubaoerjijin, Y.; Kennedy, M.; Myette-Cote, E.; Fletcher, K.; Boule, N.G. Overnight fasting compromises exercise intensity and volume during sprint interval training but improves high-intensity aerobic endurance. J. Sports Med. Phys. Fit. 2019, 59, 357–365. [Google Scholar] [CrossRef]
Van Proeyen, K.; Szlufcik, K.; Nielens, H.; Ramaekers, M.; Hespel, P. Beneficial metabolic adaptations due to endurance exercise training in the fasted state. J. Appl. Physiol. 2011, 110, 236–245. [Google Scholar] [CrossRef][Green Version]
Nybo, L.; Pedersen, K.; Christensen, B.; Aagaard, P.; Brandt, N.; Kiens, B. Impact of carbohydrate supplementation during endurance training on glycogen storage and performance. Acta Physiol. 2009, 197, 117–127. [Google Scholar] [CrossRef]
Beaudouin, F.; Joerg, F.; Hilpert, A.; Meyer, T.; Hecksteden, A. Carbohydrate intake and training efficacy—a randomized cross-over study. J. Sports Sci. 2018, 36, 942–948. [Google Scholar] [CrossRef]
Marquet, L.A.; Hausswirth, C.; Molle, O.; Hawley, J.A.; Burke, L.M.; Tiollier, E.; Brisswalter, J. Periodization of Carbohydrate Intake: Short-Term Effect on Performance. Nutrients 2016, 8, 755. [Google Scholar] [CrossRef][Green Version]
Hulston, C.J.; Venables, M.C.; Mann, C.H.; Martin, C.; Philp, A.; Baar, K.; Jeukendrup, A.E. Training with low muscle glycogen enhances fat metabolism in well-trained cyclists. Med. Sci. Sports Exerc. 2010, 42, 2046–2055. [Google Scholar] [CrossRef][Green Version]
Yeo, W.K.; Paton, C.D.; Garnham, A.P.; Burke, L.M.; Carey, A.L.; Hawley, J.A. Skeletal muscle adaptation and performance responses to once a day versus twice every second day endurance training regimens. J. Appl. Physiol. 2008, 105, 1462–1470. [Google Scholar] [CrossRef][Green Version]
Cochran, C.A.J.R.; Myslik, F.; MacInnis, M.J.; Percival, M.E.; Bishop, D.; Tarnopolsky, M.A.; Gibala, M.J. Manipulating carbohydrate availability between twice-daily sessions of high-intensity interval training over 2 weeks improves time-trial performance. Int. J. Sport Nutr. Exerc. Metab. 2015, 25, 463–470. [Google Scholar] [CrossRef] [PubMed]
Ghiarone, T.; Andrade-Souza, V.A.; Learsi, S.K.; Tomazini, F.; Ataide-Silva, T.; Sansonio, A.; Fernandes, M.P.; Saraiva, K.L.; Figueiredo, R.C.; Tourneur, Y. Twice-a-day training improves mitochondrial efficiency, but not mitochondrial biogenesis, compared with once-daily training. J. Appl. Physiol. 2019, 127, 713–725. [Google Scholar] [CrossRef] [PubMed]
Gejl, K.D.; Thams, L.B.; Hansen, M.; Rokkedal-Lausch, T.; Plomgaard, P.; Nybo, L.; Larsen, F.J.; Cardinale, D.A.; Jensen, K.; Holmberg, H.-C. No Superior Adaptations to Carbohydrate Periodization in Elite Endurance Athletes. Med. Sci. Sports Exerc. 2017, 49, 2486–2497. [Google Scholar] [CrossRef] [PubMed][Green Version]
Holloszy, J.O.; Coyle, E.F. Adaptations of skeletal muscle to endurance exercise and their metabolic consequences. J. Appl. Physiol. Respir. Environ. Exerc. Physiol. 1984, 56, 831–838. [Google Scholar] [CrossRef] [PubMed]
Larsen, S.; Nielsen, J.; Hansen, C.N.; Nielsen, L.B.; Wibrand, F.; Stride, N.; Schroder, H.D.; Boushel, R.; Helge, J.W.; Dela, F.; et al. Biomarkers of mitochondrial content in skeletal muscle of healthy young human subjects. J. Physiol. 2012, 590, 3349–3360. [Google Scholar] [CrossRef]
Andrade-Souza, V.A.; Ghiarone, T.; Sansonio, A.; Santos Silva, K.A.; Tomazini, F.; Arcoverde, L.; Fyfe, J.; Perri, E.; Saner, N.; Kuang, J.; et al. Exercise twice-a-day potentiates markers of mitochondrial biogenesis in men. FASEB J. 2020, 34, 1602–1619. [Google Scholar] [CrossRef][Green Version]
Charlot, K.; Pichon, A.; Chapelot, D. Effets de l’entraînement à jeun sur la V˙ O2max, l’oxydation des lipides et la performance aérobie chez des jeunes hommes modérément entraînés. Sci. Sports 2016, 31, 166–171. [Google Scholar] [CrossRef]
Burke, L.M.; Ross, M.L.; Garvican-Lewis, L.A.; Welvaert, M.; Heikura, I.A.; Forbes, S.G.; Mirtschin, J.G.; Cato, L.E.; Strobel, N.; Sharma, A.P.; et al. Low carbohydrate, high fat diet impairs exercise economy and negates the performance benefit from intensified training in elite race walkers. J. Physiol. 2017, 595, 2785–2807. [Google Scholar] [CrossRef][Green Version]
Burke, L.M.; Sharma, A.P.; Heikura, I.A.; Forbes, S.F.; Holloway, M.; McKay, A.K.A.; Bone, J.L.; Leckey, J.J.; Welvaert, M.; Ross, M.L. Crisis of confidence averted: Impairment of exercise economy and performance in elite race walkers by ketogenic low carbohydrate, high fat (LCHF) diet is reproducible. PLoS ONE 2020, 15, e0234027. [Google Scholar] [CrossRef]
Lundby, C.; Montero, D.; Joyner, M. Biology of VO2max: Looking under the physiology lamp. J. Acta Physiol. 2017, 220, 218–228. [Google Scholar] [CrossRef]
Impey, S.G.; Hearris, M.A.; Hammond, K.M.; Bartlett, J.D.; Louis, J.; Close, G.L.; Morton, J.P. Fuel for the work required: A theoretical framework for carbohydrate periodization and the glycogen threshold hypothesis. Sports Med. 2018, 48, 1031–1048. [Google Scholar] [CrossRef] [PubMed][Green Version]
Van Proeyen, K.; Szlufcik, K.; Nielens, H.; Deldicque, L.; Van Dyck, R.; Ramaekers, M.; Hespel, P. High-fat diet overrules the effects of training on fiber-specific intramyocellular lipid utilization during exercise. J. Appl. Physiol. (1985) 2011, 111, 108–116. [Google Scholar] [CrossRef] [PubMed][Green Version]
Durkalec-Michalski, K.; Zawieja, E.E.; Zawieja, B.E.; Jurkowska, D.; Buchowski, M.S.; Jeszka, J. Effects of Low Versus Moderate Glycemic Index Diets on Aerobic Capacity in Endurance Runners: Three-Week Randomized Controlled Crossover Trial. Nutrients 2018, 10, 370. [Google Scholar] [CrossRef] [PubMed][Green Version]
Podlogar, T.; Free, B.; Wallis, G.A. High rates of fat oxidation are maintained after the sleep low approach despite delayed carbohydrate feeding during exercise. Eur. J. Sport Sci. 2020, 1–11. [Google Scholar] [CrossRef] [PubMed]
Heikura, I.A.; Stellingwerff, T.; Burke, L.M. Self-reported periodization of nutrition in elite female and male runners and race walkers. Front. Physiol. 2018, 9, 1732. [Google Scholar] [CrossRef] [PubMed]